Структурную основу всех тканей живых организмов составляют белки, поэтому гипертрофия любой ткани, в том числе и мышечной, тесно связана с интенсивностью синтеза и катаболизма белка в данной ткани. Достоверно установлено, что регулярная тренировка вызывает гипертрофию скелетных мышц, сопровождающуюся увеличением массы сухого остатка мышц (Н.Н.Яковлев и др. 1957). Под воздействием тренировки в мышцах увеличивается содержание сократительных белков — миозина и актина, саркоплазматических и митохондриальных белков, а также мышечных ферментов (Н.Н.Яковлев 1974).
Установлено, что физическая нагрузка угнетает синтез белка в мышечной ткани непосредственно во время упражнения и активизирует катаболизм белка в начальный восстановительный период (Н.Н.Яковлев 1974), (А.А.Виру, Н.Н.Яковлев 1988).Следовательно, функциональная гипертрофия мышц происходит именно за счёт активизации синтеза белка, но никак не в результате снижения интенсивности распада белка при сохранении прежнего уровня интенсивности синтеза белка.
Тем не менее, сами механизмы воздействия тренировки на интенсивность синтеза белка в мышцах до настоящего времени в достаточно полной мере ещё не изучены.
Интенсивность синтеза белка может зависеть от множества факторов и регулироваться на всех этапах его биосинтеза. Однако ключевым этапом регуляции белкового синтеза считается этап транскрипции мРНК — первый этап биосинтеза белка, в ходе которого происходит считывание с ДНК ядра клетки информации о последовательности аминокислот в белковой молекуле и запись этой информации в молекуле матричной РНК, на основе которой затем в цитоплазме клетки осуществляется сборка белковой молекулы.
Согласно общепринятой на сегодня концепции Ф.Жакоба и Ж.Моно (излагается по Т.Т.Берёзов и Б.Ф.Коровкин 1998, М.Сингер и П.Берг 1998), в молекуле ДНК имеются не только структурные гены (то есть те гены, которые кодируют белки, обеспечивающие функционирование клетки), но также и гены, регулирующие активность самих структурных генов — то есть так называемые "гены-операторы" и "гены-регуляторы" (см. рис. 1).
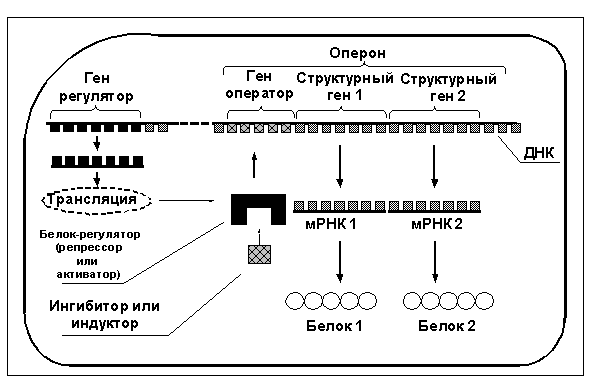
Рисунок 1
Комплекс генов, состоящий из гена-оператора и одного или нескольких структурных генов, экспрессия (то есть процесс активизации транскрипции мРНК на данном гене и синтезготовой мРНК) которых регулируется совместно, называется опероном. Транскрипция мРНК на структурных генах оперона возможна лишь тогда, когда ген-оператор находится в активном состоянии. На ген-оператор могут воздействовать специфические белки, экспрессируемые геном-регулятором, которые могут как блокировать ген-оператор (в этом случае регуляторный белок называется репрессором, а схема регуляции называется отрицательной регуляцией), так и активировать ген-оператор (в этом случае регуляторный белок называется активатором транскрипции, а схема регуляции называется положительной регуляцией).
В свою очередь, регуляторные белки подвержены влиянию определённых низкомолекулярных веществ, которые при соединении с регуляторным белком изменяют его структуру так, что тот либо получает возможность связаться с геном-оператором, либо возможность связывания белка-регулятора с геном-оператором блокируется. Набор регуляторных белков, а также низкомолекулярных веществ, индуцирующих или ингибирующих транскрипцию мРНК, индивидуален для каждого оперона и до настоящего времени для большинства генов человека в точности не определён.
Наиболее полно изучена регуляция транскрипции ферментов в клетках прокариот, то есть простейших безъядерных одноклеточных живых существ. Как правило, индукторами транскрипции мРНК того или иного фермента у прокариот выступают субстраты — исходные вещества, подвергающиеся в клетке определённым превращениям под действием фермента. А продукты протекающих в клетке химических реакций, являющиеся результатом переработки субстратов, могут выполнять роль ингибиторов транскрипции мРНК фермента. Таким образом, при появлении в клетке субстратов, требующих дальнейшей переработки, индуцируется синтез ферментов, осуществляющих такую переработку, а при снижении концентрации субстратов и накоплении продуктов реакции транскрипция фермента блокируется.
Например, если бактерии E.coli попадают в раствор глюкозы, то они приспосабливаются к перевариванию именно глюкозы, то есть ферменты, расщепляющие более сложные углеводы, у этих бактерий не вырабатываются. Если же глюкозу в питательном растворе заменить молочным сахаром — лактозой, то E.coli некоторое время не могут питаться и размножаться, поскольку ген лактазы — фермента, расщепляющего лактозу на глюкозу и галактозу, блокирован у данных бактерий белком-репрессором, и они не синтезируют данный фермент. Однако уже через некоторое время после замены питательной среды лактоза, поглощаемая бактериями E.coli, соединяется с белком-репрессором гена, кодирующего лактазу, и репрессор теряет способность связываться с ДНК и перестает блокировать синтез мРНК лактазы. В результате таких процессов в бактериальной клетке активируется синтез нужного фермента, бактерии получают возможность переваривать молочный сахар, и снова начинают размножаться. При этом белок-репрессор продолжает постоянно вырабатываться бактериальной клеткой, но новые молекулы лактозы связываются с репрессором и инактивируют его. Как только бактерии переработают всю лактозу, инактивирование белка-респрессора лактозой становится невозможным и активный репрессор вновь блокирует ген, кодирующий лактазу — фермент, потребность в котором уже отпала. Таков механизм, благодаря которому через активность генов регулируется адаптивная реакция клетки на изменение условий её существования.
Регуляция транскрипции в клетках эукариот, то есть живых существ, клетки которых имеют ядра, может происходить по принципиально схожим, но гораздо более сложным схемам, так как процессы транскрипции мРНК и сборки на её основе белковой молекулы разобщены как мембраной ядра, так и временным интервалом (у эукариот синтез мРНК происходит в ядре клетки, а сборка белковой молекулы осуществляется вне ядра, непосредственно в цитоплазме). В многоклеточных организмах преобладает положительная регуляция активности генов, и для каждого оперона имеется не менее пяти участков ДНК, с которыми должно произойти связывание специфических белков-регуляторов для того, чтобы началась транскрипция структурных генов данного оперона. Для ряда оперонов в качестве индукторов транскрипции мРНК могут выступать стероидные гормоны.
При моделировании воздействия тренировочной нагрузки на функциональное состояние мышц в целом и на их гипертрофию в частности современная спортивная теория опирается на концепцию срочной и долговременной адаптации мышц к нагрузке (Калинскийи др. 1986), (А.А.Виру, Н.Н.Яковлев 1988), (Ф.З.Меерсон, М.Г.Пшенникова 1988),(Ф.З.Меерсон 1993), которая уже вошла в учебники (Н.И.Волков и др. 2000). Согласно данной концепции, физическая нагрузка вызывает существенные изменения во внутренней среде мышц, и изменения эти связаны, в основном, с нарушением энергетического баланса (то есть со снижением содержания в мышцах АТФ, креатинфосфата, гликогена, а также с накоплением продуктов энергетического метаболизма — АДФ, АМФ, свободного креатина, ортофосфата, молочной кислоты и др.). Указанные изменения во внутренней среде мышц стимулируют процессы адаптации организма к новым условиям существования.
Первичная реакция организма на нагрузку, получившая название срочной адаптационной реакции, сводится, в основном, к изменению энергетического обмена в мышцах и организме в целом, а также к изменениям в системе его вегетативного обслуживания. В ходе срочных адаптационных процессов в мышцах накапливаются вещества, активирующие транскрипцию мРНК структурных генов либо непосредственно, либо через индукцию синтеза белков-регуляторов, управляющих активностью генов структурных белков мышц. При повторяющихся тренировочных нагрузках, благодаря регулярной активации генетического аппарата мышечных клеток, в мышцах увеличивается содержание структурных белков, вследствие чего мышцы становятся более резистентными к задаваемой нагрузке — именно таким образом в мышцах и развивается долговременная адаптация. Принципиальная схема взаимосвязи звеньев срочной и долговременной адаптации изображена на рисунке 2 (позаимствовано из работы Калинского и др. 1986,Н.И.Волкова и др. 2000).
В качестве первичной причины, запускающей механизмы воздействия на генетический аппарат мышечной клетки и в конечном итоге активирующей синтез мРНК структурных белков, чаще всего рассматривается истощение внутриклеточных энергетических ресурсов, уменьшение в саркоплазме концентрации АТФ и креатинфосфата и возрастание содержания АДФ, АМФ и креатина.
Ф.З.Меерсон отмечает, что то, какой именно внутриклеточный сигнал оказывает непосредственное воздействие на генетический аппарат клетки, достоверно не установлено, и в качестве гипотезы выдвигает на роль данного первичного сигнала повышение в саркоплазме концентрации ионов водорода — то есть ацидоз мышц, вызванный накоплением кислых продуктов метаболизма (Ф.З.Меерсон 1993). В концепции долговременной адаптации Меерсона ацидоз воздействует на синтез мРНК структурных белков не непосредственно, а через активацию протоонкогенов c-myc и c-foc — ранних генов, экспрессирующих регуляторные белки, которые, в свою очередь, активируют гены структурных белков.
Ряд спортивных методистов при обосновании своих тренировочных концепций также рассматривают ацидоз мышц как важный фактор запуска белкового синтеза — однако с их точки зрения, ацидоз оказывает своё влияние на активность генетического аппарата клетки через облегчение доступа других факторов транскрипции к наследственной информации(В.Н.Селуянов 1996), (Е.Е.Аракелян и др. 1997). Последнее, по мнению упомянутых авторов, достигается посредством увеличения проницаемости клеточных мембран, в том числе ядерных мембран, раскручивания спирали ДНК и ряда других процессов, активизирующихся в клетке при повышении концентрации H+. Прямое же воздействие на ДНК клетки, индуцирующее синтез сократительных белков, согласно мнению этих же авторов, оказывает креатин, концентрация которого возрастает в саркоплазме работающих мышц вследствие интенсивного восстановления АТФ за счёт креатинфосфата. На креатин как на фактор-активатор белкового синтеза указывается и в современных учебных пособиях по биохимии спорта (Н.И.Волков и др. 2000).
Принципиально схожая концепция регуляции белкового синтеза рассмотрена Дж.Мак-Комасом — с тем лишь отличием, что в роли спускового механизма, включающего транскрипцию мРНК сократительных белков мышц, в данной концепции выступают не ассоциируемые с утомлением мышц факторы, а механическое растяжение волокон, возникающее в процессе двигательной активности мышц (А.Дж.Мак-Комас 2001).Предполагается, что напряжение цитоскелета мышечных волокон, в особенности во время эксцентрической фазы движения (то есть при удлинении напряжённого мышечного волокна под действием внешней силы), вызывает высвобождение ряда факторов (возможно, включая простагландины), активирующих индукцию ранних генов, белки которых, в свою очередь, активируют гены сократительных белков мышц.
Увеличенное механическое напряжение сердечной мышцы при повышении кровяного давления в качестве возможного фактора, активизирующего экспрессию регуляторных генов в кардиомиоцитах, рассматривает и Меерсон. Однако последний ввиду того, что механические факторы влияют на активность регуляторных генов только в бьющемся, в работающем сердце, склоняется к превалированию именно метаболических факторов в активации регуляторных генов (Ф.З.Меерсон 1993). По мнению Меерсона, гипертрофия сердечной мышцы при повышении механического напряжения развивается по следующей схеме:
Нагрузка —> увеличение механической активности —> дефицит энергии —> снижение pH —> активация экспрессии протоонкогенов —> синтез белков-регуляторов —> активация синтеза сократительных белков —> компенсаторная гипертрофия.
Таким образом, в настоящее время среди исследователей нет единого мнения о том, какие именно процессы, сопровождающие физическую нагрузку, выполняют роль спускового механизма транскрипции мРНК структурных белков мышц. Объединяет же все приведённые выше концепции то, что функциональная гипертрофия мышц рассматривается в них в качестве следствия интенсификации синтеза мРНК структурных белков в ядрах мышечных клеток.
Существенный и принципиальный недостаток всех подобного рода концепций заключён в том, что при описанном подходе либо остаётся в тени, либо начисто выпадает из поля зрения исследователей наиважнейший фактор, определяющий объём синтезируемого в мышечной ткани белка, а именно: число молекул ДНК, на которых и происходит транскрипция мРНК.
Меерсон отмечает, что содержание ДНК в мышце является важным параметром, влияющим на синтез белка, но рассматривает данный параметр, в основном, как генетическую детерминанту, тесно связанную с функциональным предназначением той или иной мышечной ткани. Так, Меерсон отмечает, что для скелетных мышц, для левого и для правого желудочков сердечной мышцы масса мышечной ткани, приходящаяся на одну молекулу ДНК, различна (Ф.З.Меерсон 1993). Иными словами, чем интенсивнее функционирует мышечная ткань в процессе жизнедеятельности организма, тем выше в нейплотность ДНК.
Меерсон отмечает также и то, что в организме молодых животных функциональная адаптация сердца возможна через активацию деления кардиомиоцитов и их гиперплазию, однако осознание Меерсоном возможности такого пути адаптации сердечной мышцы к физической нагрузке не меняет его представлений о принципиальной схеме регуляции белкового синтеза в мышечной ткани.
А.А.Виру и Н.Н.Яковлев упоминают о включении меченых атомов в ДНК мышечных клеток после тренировки (А.А.Виру, Н.Н.Яковлев 1988), — что является свидетельством новообразования молекул ДНК. Однако при рассмотрении биохимических путей воздействия тренировочной нагрузки на мышцы данные исследователи основное своё внимание также уделяют интенсификации транскрипции РНК структурных белков под воздействием продуктов энергетического обмена.
Увеличение количества ДНК в скелетных мышцах как возможный фактор гипертрофии мышц Н.Н.Селуянов не рассматривает совсем. Объём белка, синтезируемого мышечной клеткой, в разработанной Селуяновым модели воздействия тренировки на организм человека является функцией времени активации транскрипции мРНК сократительных белков под воздействием повышенной в ходе активности мышц концентрации креатинаи Н+ (В.Н.Селуянов 1996).
Возможность увеличения содержания ДНК в скелетных мышцах в качестве фактора гипертрофии скелетных мышц остаётся практически без рассмотрения и в современных учебных пособиях (Н.И.Волков и др. 2000), (А.Дж.Мак-Комас 2001).
Мышечные волокна являются многоядерными клетками, образующимися в период развития эмбриона путём слияния эмбриональных миобластов в длинные продолговатые трубчатые структуры — миотубы, которые в дальнейшем, после контакта с прорастающими аксонами мотонейронов и синтеза в миотубах миофибрилл, преобразуются в мышечные волокна (Р.К.Данилов 1994), (Э.Г.Улумбеков, Ю.А.Челышев 1998), (А.Дж.Мак-Комас 2001),(Е.А.Шубникова и др. 2001). Число ядер в мышечном волокне определяется числом образовавших его миобластов и, как показывает ряд рассмотренных ниже исследований, число ядер в уже сформированных мышечных волокнах не является неизменным.
Хорошо известно, что мышцы животных и человека в процессе роста организма кардинально увеличивают свои размеры, массу и силу. Чтобы достигнуть размера, характерного для мышц взрослого человека, брюшко мышцы ребенка должно увеличиться примерно в 20 раз (А.Дж.Мак-Комас 2001). Ещё в 60-е годы прошлого века было установлено, что по мере роста организма животных в их мышечных волокнах кардинально увеличивается число ядер (M.Enesco, D.Puddy 1964), (F.P.Moss 1968). Было обнаружено, что для людей в возрасте от одного до семидесяти одного года объём мышечного волокна хорошо коррелирует с числом ядер в мышечном волокне, и объём мышечного волокна, приходящийся на одно ядро, фактически является постоянной величиной во всём исследованном возрастном диапазоне (D.Vassilopoulos et al. 1977).
Поначалу причина увеличения числа ядер в мышечных волокнах оставалась не вполне ясной, так как было известно, что ядра миобластов после слияния в мышечные волокна утрачивают способность к делению. В то же время было известно, что не все ядра мышечных волокон обладают одинаковыми свойствами; в частности, небольшая часть ядер (3-10%)отличается от основной их массы — ядра из этой небольшой части расположены в оболочке волокна между плазмолеммой и базальной мембраной, то есть отделены от саркоплазмы собственной оболочкой и представляют собой, по сути, отдельные клетки (A.Mauro 1961).Данные клетки получили название клеток-сателлитов или миосателлитоцитов. Впоследствии было обнаружено, что именно деление миосателлитоцитов и последующее их слияние с основным мышечным волокном является причиной увеличения числа ядер в мышечном волокне по мере роста организма (F.P.Moss, C.P.Leblond 1970).
Увеличение числа ядер в мышечных волокнах происходит во взрослом, уже сформированном организме под воздействием тренировки. Обнаружено, что гипертрофия мышц крыс, вызванная принудительным плаванием либо перегрузкой из-за отсечения мышц-синергистов, не сопровождается изменением плотности ядер в мышечных волокнах(D.Seiden 1976), что является свидетельством увеличения числа ядер пропорционально увеличению объёма мышечных волокон. Зафиксировано, что после тренировки плаванием дважды в неделю в течение тридцати пяти дней число клеточных ядер в extensor digitorum longus крыс возросло на 30% (N.T.James, M.Cabric 1981). Затем эти же исследователи обнаружили увеличение числа ядер в vastus lateralis собак, тренированных в беге (M.Cabric,N.T.James 1983). Перегрузка мышц задних конечностей кошек, вызванная отсечением gastrocnemius и soleus, сопровождается значительной гипертрофией plantaris и в течение трёх месяцев приводит к почти четырёхкратному увеличению числа ядер в быстрых волокнах и двукратному увеличению числа ядер в медленных волокнах этой мышцы (D.L.Allen et al. 1995).Отмечено увеличение числа ядер и в мышцах людей после электрически стимулируемого сокращения мышц (M.Cabric et al. 1987), аэробной (велотренажёр) и анаэробной (подъём ног с отягощением) тренировки (P.J.Pacy et al. 1987), тренировок со штангой (F.Kadi et al. 1999 a),(F.Kadi et al. 1999 b).
Источником новых ядер, появляющихся в мышечных волокнах под воздействием тренировки, равно как и в результате возрастной гипертрофии мышц, являются клетки-сателлиты. Так, было замечено, что длительное интенсивное движение по беговой дорожке с наклоном вниз (с преобладанием работы мышц в уступающем режиме), вызывает у крыс повреждение части мышечных волокон и активирует пролиферацию (то есть массированное деление и последующее дифференцирование клеток в сторону специализации на выполнении определённой функции) клеток-сателлитов с пиком активности данных клетокчерез 24-76 часов после нагрузки. При этом уровень активации клеток-сателлитов был выше, чем того требовалось бы для восстановления повреждённых волокон, то есть клетки-сателлиты были активированы не только в повреждённых волокнах, но и в тех волокнах, у которых не наблюдалось внешних признаков повреждения (K.C.Darr, E.Schultz 1987).Двукратное увеличение активности деления клеток-сателлитов зафиксировано в мышцах крыс после десяти недель беговых тренировок (K.M.McCormick, D.P.Thomas 1992). Отсечение мышц-синергистов (plantaris и gastrocnemius) у крыс вызывает перегрузку soleus, что активизирует деление клеток-сателлитов в данной мышце в первую неделю после начала перегрузки и впоследствии приводит к значительной гипертрофии soleus (M.H.Snow 1990).Процессы активации клеток-сателлитов и слияния их с мышечными волокнами были отмечены в мышцах людей при регулярных тренировках на велотренажёре (H.J.Appell etal. 1988). Обнаружено, что тренировка с отягощением приводит к увеличению в мышцах человека пропорции клеток-сателлитов и увеличивает процент морфологически активныхклеток-сателлитов (Roth SM et al. 2001).
Как уже упоминалось выше, в ряде исследований было отмечено, что увеличение числа ядер в мышечных волокнах при их гипертрофии происходит таким образом, что объём волокна, приходящийся на одно ядро, остаётся практически неизменнойвеличиной (D.Seiden 1976), (D.Vassilopoulos et al. 1977). Было выдвинуто предположение, что отношение объёма мышечного волокна к числу ядер в нём, то есть объём мышечной клетки, контролируемый одним ядром (так называемая ДНК-единица (DNA-unit)), является величиной постоянной, и в организме заложены механизмы поддержания еёпостоянства (D.B.Cheek 1985). Впоследствии данная точка зрения неоднократно подтверждалась. Так, было показано, что мышцы крыс, подвергшиеся функциональной перегрузке в результате удаления мышц-синергистов, демонстрируют значительно большую гипертрофию при регулярном инъекционном введении гормона роста в сравнении с мышцами крыс, не получавшими инъекции гормона. Однако отношение объёма волокна к числу ядер в нём оказалось одинаковым не только у крыс, получавших и не получавших инъекции гормона, но и у тех крыс, мышцы которых не подвергались функциональной перегрузке и не увеличивались (G.E.McCall et al. 1998). Было обнаружено, что увеличенный относительно контрольной группы (составленной из людей, не занимавшихся поднятием тяжестей) объём мышечных волокон в трапециевидных мышцах высокотренированных пауэрлифтёров хорошо коррелирует с увеличенным числом ядер в данных мышцах — то естьразмер ДНК-единицы в мышцах спортсменов не превышает размера ДНК-единицы в мышцах представителей контрольной группы (F.Kadi et al. 1999 а). Сравнение мышц пауэрлифтёров, которые, по их собственному признанию, в течение нескольких последних лет принимали анаболические стероиды, с мышцами атлетов, воздерживавшихся от применения этих препаратов, показало, что между данными группами спортсменов нет существенного различия в размере ДНК-единицы (F.Kadi et al. 1999 b).
Однако из того факта, что гипертрофия мышечного волокна сопровождается, как правило, пропорциональным увеличением числа ядер в нём, никак нельзя делать вывод, что размер мышечного волокна во всех случаях определяется только числом ядер. Ограниченное увеличение размера ДНК-единицы происходит на ранних этапах развития организма. Обнаружено, что в организме молодых растущих крыс мышцы, в которых деление миосателлитоцитов блокировано воздействием радиации, всё же немного увеличивают свой размер и массу, хотя и значительно отстают в росте от необлучённых мышц, в которых деление миосателлитоцитов происходит в обычном порядке (P.E.Mozdziak et al. 1997). В этих же экспериментах было показано, что в мышцах, подвергшихся облучению, и в необлучённых мышцах размер ДНК-единицы возрастает в равной степени, то есть увеличениеразмера ДНК-единицы на ранних этапах развития организма является физиологически запрограммированным. Связан такой рост объёма волокна, обслуживаемого одним ядром, по-видимому, с тем, что размер ДНК-единицы мышечного волокна в молодом организме меньшеразмера ДНК-единицы, характерного для мышц зрелого организма. Возможно, увеличениеразмера ДНК-единицы на ранних этапах развития организма связано с возрастающей после рождения двигательной активностью мышц — на это указывает тот факт, что снятие нагрузки с растущих мышц прерывает увеличение размера ДНК-единицы (P.E.Mozdziak et al. 2000).Вместе с тем возможности увеличения размера ДНК-единицы, по-видимому, ограничены, поскольку в облучённых мышцах дополнительного увеличения размера ДНК-единицы,компенсирующего отставание мышц в развитии из-за меньшего числа ядер, непроисходит (P.E.Mozdziak et al. 1997).
Впрочем, снижение размера ДНК-единицы возможно в стареющем организме. В противоречие исследованиям, в которых постоянство размера ДНК-единицы было отмечено в мышцах людей в возрасте от одного до семидесяти одного года (D.Vassilopoulos et al. 1977),при аналогичных исследованиях мышц людей в возрастном диапазоне от семнадцати до восьмидесяти двух лет было обнаружено снижение размера ДНК-единицы в мышцах людей старше шестидесяти лет (P.Manta et al. 1987), то есть в мышцах пожилых людей наблюдалось снижение среднего размера волокон при сохраняющемся числе ядер. Возможно, такоеуменьшение ДНК-единицы связано со снижением с возрастом двигательной активности людей.
При атрофии мышц, вызванной значительным снижением двигательной активности, также отмечается снижение размера ДНК-единицы. Например, после денервации мышц кролика наблюдалась атрофия мышц, сопровождавшаяся снижением размера ДНК-единицы(J.A.Gustafsson et al. 1984). При снятии нагрузки с мышц задней конечности крыс в течение двадцати восьми дней число ядер в мышцах крыс не уменьшилось, в то время как размер волокон существенно снизился (до 70% от уровня контроля в быстрых и до 45% от уровня контроля в медленных). Следовательно, размер ДНК-единицы в атрофированных мышцах заметно снизился — в особенности, в медленных волокнах (C.E.Kasper, L.Xun 1996).Соблюдение группой добровольцев длительного (до четырёх месяцев) постельного режима привело к существенному (на 35% от первоначального уровня) снижению поперечного сечения мышечных волокон в камбаловидной мышце (95% волокон камбаловидной мышцы — медленные), при этом число ядер в волокнах осталось неизменным, то есть бездействие мышц привело к существенному снижению размера ДНК-единицы медленныхволокон (Y.Ohira et al. 1999). В указанных экспериментах атрофия мышц не сопровождалась снижением числа клеточных ядер в мышечных волокнах, но в ряде случаев при атрофии мышц наблюдалось как уменьшение размера ДНК-единицы, так и уменьшение числа ядер. Например, в мышцах задней конечности кошек после шести месяцев бездействия (по причине спиноизоляции, то есть изоляции спинного мозга от воздействия головного) было отмечено как снижение размера ДНК-единицы, так и уменьшение числа ядер (D.L.Allen et al. 1995). В мышцах крыс после двухнедельного пребывания в невесомости зафиксировано как уменьшение числа ядер в медленных мышечных волокнах, так и уменьшениеразмера ДНК-единицы медленного волокна, при этом число ядер и размер ДНК-единицы в быстрых волокнах остались неизменными (D.L.Allen et al. 1996). Признаки апоптоза (то есть самоуничтожения ДНК) ядер обнаружены в мышцах крыс как после двухнедельного космического полёта (D.L.Allen et al. 1997), так и после нескольких дней фиксации мышц кролика в сокращённом состоянии (H.K.Smith et al. 2000).
Итак, уменьшение интенсивности синтеза белка и снижение размера ДНК-единицыявляется основным фактором атрофии мышечных волокон при их длительном бездействии, однако определённый вклад в атрофию скелетных мышц могут вносить также приостановка деления клеток-сателлитов и гибель уже существующих ядер. Известно, что атрофия мышц, вызванная гипокинезией, обратима (X.J.Musacchia et al. 1980), (Y.Ohira et al. 1999). При восстановлении после атрофии происходит восстановление и даже некоторое увеличениеразмера ДНК-единицы (Y.Ohira et al. 1999).
Умеренное повышение размера ДНК-единицы может происходить не только в постнатальный (послеродовой) период или при восстановлении мышц после атрофии, но и при функциональной гипертрофии мышц. Так, в уже упомянутых экспериментах (D.L.Allen et al. 1995) гипертрофия медленных волокон в перегруженных мышцах кошек сопровождалась увеличением размера ДНК-единицы примерно на 28%. Однако увеличение размера ДНК-единицы не внесло существенного вклада в гипертрофию мышц, поскольку наблюдавшееся приращение размера ДНК единицы могло увеличить площадь поперечного сечения медленных волокон всего на 28%, в то время как в целом площадь поперечного сечения увеличилась примерно в 2,5 раза (главным образом за счёт почти двукратного увеличения числа ядер).
Те обстоятельства, что размер ДНК-единицы зависит от уровня двигательной активности мышц, но возможности приращения размера ДНК-единицы при увеличении нагрузки на мышцы в то же время весьма ограничены, свидетельствуют, по-видимому, о том, что существует предельный объём мышечного волокна, который способно обслуживать одно ядро.
Есть предположение, что ограниченность размера ДНК-единицы может быть связана с расстояниями от ядра, на которые возможна эффективная доставка мРНК либо синтезированных белков (R.R.Roy et al. 1999).
Так, in vitro было показано, что в многоядерных клетках мРНК сосредоточена в ограниченном объёме вокруг экспрессирующего её ядра (E.Ralston, Z.W.Hall 1992), вокруг ядра же локализованы и на определённом удалении от него не встречаются белки, синтезированные на основе мРНК, экспрессируемой ядром (G.K.Pavlath et al. 1989).
Вместе с тем лимитирующим размер ДНК-единицы фактором может служить достижение предела возможностей одного ядра по синтезу определённых видов РНК. В пользу последнего свидетельствует тот факт, что медленные волокна при том же или даже меньшем размере, что и быстрые, имеют большее число ядер — соответственно, плотность ядер в медленных волокнах выше, а размер ДНК-единицы меньше, чем в быстрыхволокнах (I.G.Burleigh 1977), (J.A.Gustafsson et al. 1984), (B.S.Tseng et al. 1994),(C.E.Kasper, L.Xun 1996), (R.Roy et al. 1999). Возможно, большая плотность ядер в медленных волокнах обусловлена тем, что обмен белкового вещества в медленных волокнах примерно в два раза выше, чем в быстрых (F.J.Kelly et al. 1984), и предел возможностей ядра по синтезу некоторых видов РНК в медленных волокнах легко достижим, а потому ядра медленных волокон способны обслуживать меньший объём саркоплазмы, чем ядра быстрых. Статистический анализ распределения ядер в мышечных волокнах различного диаметра показал, что в медленных волокнах по мере увеличения их диаметра имеется тенденция к сохранению объёма волокна, обслуживаемого одним ядром, а в быстрых волокнах имеется тенденция к сохранению площади поверхности волокна (ядра в зрелых волокнах расположены непосредственно под оболочкой), приходящейся на одно ядро (J.C.Bruusgaard etal. 2003). Последнее наблюдение свидетельствует в пользу того, что в медленных волокнах ограничителем размера ДНК-единицы в большей степени являются возможности ядра всинтезе РНК, а в быстрых волокнах ограничителем выступают транспортные расстояния.
При решении вопроса о необходимости пересмотра концепции, увязывающей гипертрофию скелетных мышц с активацией транскрипции мРНК структурных белков, следует в первую очередь узнать ответ вот на какой вопрос: является ли увеличение числа ядер в мышечных волокнах первичной причиной гипертрофии волокон или же это следствие всё тех же процессов интенсификации синтеза мРНК?
На первом этапе адаптации мышц к нагрузке может происходить интенсификациятранскрипции мРНК и усиление синтеза белка и, как следствие, наблюдаться ростразмера ДНК-единицы. А уже вслед за этим в качестве адаптации к увеличенномуразмеру ДНК-единицы может происходить активация клеток-сателлитов и увеличение числа ядер в волокне, то есть восстановление оптимального размера ДНК-единицы. Против последнего предположения свидетельствует ряд следующих приведённых ниже фактов.
Было обнаружено, что активация и быстрое увеличение клеток-сателлитов в мышечных волокнах является первичной реакцией на различные виды перегрузки мышц животных, как то: растягивание мышц перепелов путём прикрепления груза к крыльям (M.H.Snow 1990) или перегрузка мышц крыс, вызванная удалением мышц-синергистов (P.K.Winchester et al. 1991).Активация миосателлитоцитов наблюдается в первые дни после начала перегрузки мышц, а вот существенная гипертрофия мышц наблюдается уже впоследствии.
В ряде исследований было отмечено, что гипертрофия мышц не только не является следствием увеличения размера ДНК-единицы, но, наоборот, размер ДНК-единицы при гипертрофии мышц может даже уменьшиться. Так, в быстрых волокнах кошек, подвергнутых функциональной перегрузке из-за удаления мышц-синергистов, наблюдается снижениеразмера ДНК-единицы на фоне почти четырёхкратного увеличения числа ядер (D.L.Allen etal. 1995).
Инъекции тестостерона в течение двадцати недель в дозировке 300-600 мг в неделю привели к гипертрофии vastus lateralis человека, при этом размер ДНК-единицы в мышечных волокнах данной мышцы не только не был увеличен, но, наоборот,уменьшился (I.Sinha-Hikim et al. 2003), то есть гормонально индуцируемая гипертрофия мышечных волокон произошла исключительно за счёт увеличения числа ядер.
Отсечение определённых мышц у животных вызывает компенсаторную гипертрофиюмышц-синергистов — например, удаление у крыс tibialis anterior вызывает гипертрофию extensor digitorum longus, однако если до удаления tibialis anterior в digitorum longus блокировать возможность деления клеток-сателлитов, обработав мышцы крыс радиацией, то компенсаторной гипертрофии extensor digitorum longus не наблюдается (J.D.Rosenblatt etal. 1994). Это свидетельствует о том, что сколько-нибудь существенная гипертрофия мышечных волокон только за счёт интенсификации синтеза мРНК без увеличения числа ядер в волокне просто невозможна.
Итак, можно считать достоверно установленным, что активация клеток-сателлитов,приводящая к увеличению числа ядер в мышечном волокне, является именно причиной гипертрофии мышечных волокон, но никак не её следствием.
В связи с тем, что тренировка активирует деление клеток-сателлитов и их последующее слияние с "материнским" волокном, встаёт вопрос: а возможно ли объединениеклеток-сателлитов в новые волокна, как это происходит с миобластами в период эмбрионального формирования скелетных мышц? То есть возможна ли гиперплазия мышечных волокон?
Хорошо известно, что при повреждении мышц клетки-сателлиты, высвободившиеся из оболочки отмирающих по тем или иным причинам волокон, сливаются в новые волокна, за счёт чего и происходит регенерация повреждённой ткани (E.V.Dmitrieva 1975),(M.H.Snow 1977), (W.E.Pullman, G.C.Yeoh 1978), (Р.К.Данилов 1994), (А.В.Володина 1995),(Э.Г.Улумбеков, Ю.А.Челышев 1998), (Е.А.Шубникова и др. 2001). Как правило, при сохранении структуры мышцы новые мышечные волокна формируются в области, ограниченной базальной мембраной старого волокна, то есть замещают собой повреждённые волокна. Такие регенерационные процессы после тренировки происходят в мышцах всех животных. Об этом свидетельствуют исследования, в которых при различных видах функциональной перегрузки мышц животных были зафиксированы повреждения мышечных волокон и последующие регенерационные процессы, связанные с активациейклеток-сателлитов (K.C.Darr, E.Schultz 1987), (M.H.Snow 1990), (K.M.McCormick,D.P.Thomas 1992), (P.K.Winchester, W.J.Gonyea 1992), (T.Tamaki et al. 1997), а также исследования, позволившие после различных видов функциональной перегрузки мышц как лабораторных животных, так и человека обнаружить в этих мышцах тонкие волокна с формирующимся сократительным аппаратом (A.Salleo et al. 1980), (C.J.Giddings,W.J.Gonyea 1992), (P.K.Winchester, W.J.Gonyea 1992), (K.M.McCormick, D.P.Thomas 1992),(T.Tamaki et al. 1997), (V.F.Kondalenko et al. 1981), (H.J.Appell et al. 1988), (F.Kadi et al 1999 а).
Но можно ли считать молодые мышечные волокна свидетельством именно гиперплазии, то есть увеличения числа волокон в мышце? Не является ли появление данных волокон результатом исключительно заместительной регенерации? A.Salleo с соавторами зафиксировали в мышцах крыс, испытывавших перегрузку после отсечениямышц-синергистов, отделение клеток-сателлитов от оболочки мышечного волокна, их последующее интенсивное деление и затем слияние в продолговатые структуры, которые затем становились новыми мышечными волокнами (A.Salleo et al. 1980). Образование новых волокон в межклеточном пространстве было зафиксировано также в перегруженных мышцахцыплят (J.M.Kennedy et al. 1988) и крыс (T.Tamaki et al. 1997). Поскольку молодые мышечные волокна могут образовываться как в дополнение к существующим волокнам, так и взамен волокон, подвергшихся некрозу, наличие таких волокон в мышцах животных или человека после тренировки нельзя считать достаточным свидетельством гиперплазии волокон. С уверенностью констатировать факт гиперплазии волокон можно лишь в тех случаях, когда удаётся зафиксировать собственно увеличение числа волокон в мышце.
Увеличение числа мышечных волокон в мышцах крыс наблюдается в первые недели после рождения (J.Rayne, G.N.Crawford 1975), (T.Tamaki 2002). Однако многие исследователи склоняются к мнению, что гипертрофия мышц животных в зрелом возрасте не связана с гиперплазией и полностью объясняется гипертрофией уже существующих волокон. Так, в ряде экспериментов увеличение числа волокон при гипертрофии мышц крыс, вызванной удалением мышц-синергистов, зафиксировано не было (P.D.Gollnick et al. 1981), (B.F.Timson etal. 1985), (M.H.Snow, B.S.Chortkoff 1987). Длительное растягивание мышц нелетающих птиц, осуществлённое посредством прикрепления к крыльям груза, сопровождающееся гипертрофией мышц, также не привело к увеличению числа волокон (P.D.Gollnick et al. 1983),(J.Antonio, W.J.Gonyea 1993 a).
В то же время, несмотря на отрицательный результат ряда упомянутых выше экспериментов, удалось зафиксировать гиперплазию волокон в мышцах птиц, подвергнутых хроническому растягиванию. В экспериментах S.E.Alway с соавторами к одному крылу перепелов прикреплялся груз, равный 10% от веса тела птицы, и после месяца перегрузки число волокон в растягивавшейся мышце на 51,8% превысило число волокон в ненагруженной мышце, использованной как контрольный объект (S.E.Alway et al. 1989 b).Аналогичные эксперименты, но с прогрессивным увеличением массы груза, привели к ещё большему увеличению числа волокон — на 82% после двадцати восьми днейперегрузки (J.Antonio, W.J.Gonyea 1993 b).
Обнаружены и свидетельства гиперплазии мышечных волокон в тренированных мышцах млекопитающих. W.Gonyea и его соавторы одними из первых зафиксировали гиперплазию в мышцах млекопитающих (W.J.Gonyea et al. 1977). В ходе данного эксперимента кошки были приучены поднимать одной из лап груз, а стимулом к поднятию груза являлось пищевое вознаграждение. После сорока шести недель занятий мышцы тренированных и нетренированных лап кошек были подвергнуты гистохимическому анализу. Общее количество мышечных волокон в тренированных лапах было на 19,3% больше, чем в нетренированных. Результаты этих исследований впоследствии были подтверждены аналогичными экспериментами (W.J.Gonyea et al. 1986). Увеличение на 14% числа мышечных волокон зафиксировано и в мышцах задних конечностей крыс, регулярно (4-5 раз в неделю) втечение 12 недель выполнявших с помощью специально сконструированного устройства упражнение, аналогичное приседаниям с весом (T.Tamaki et al. 1992). Однако, несмотря на успехи в экспериментах с животными, прямых свидетельств увеличения числа мышечных волокон в мышцах человека до сих пор обнаружено не было.
По мнению ряда исследователей, гипертрофия мышц человека в результате тренировки полностью объяснима гипертрофией уже существующих волокон, новые же волокна в результате тренировки не образуются (Б.С.Шекман 1990), (G.E.McCall et al. 1996). Вместе стем, G.E.McCall с соавторами не рискнули сделать однозначное заключение о том, что гиперплазия у человека принципиально невозможна, поскольку у ряда индивидов увеличение поперечного сечения мускула, вызванное тренировкой, не коррелировало с увеличением среднего поперечного сечения волокон (G.E.McCall et al. 1996).
То, что прямые свидетельства гиперплазии волокон в мышцах человека до сих пор не обнаружены, возможно, связано с ограниченностью применимых к человеку методов функциональной перегрузки и методов оценки числа волокон в мышцах: ведь такие методы функциональной перегрузки, как длительное многодневное растягивание мышц (в наибольшей степени вызывающее гиперплазию волокон у животных), к человеку применить довольно затруднительно. Существенная гипертрофия мышц человека (как в случае экстремального развития мышц профессиональных бодибилдеров, тяжелоатлетов и пауэрлифтёров) происходит в течение многих лет тренировок; сравнение же числа волокон в мышцах спортсменов до начала тренировок и после многолетнего периода тренировок никогда не проводилось.
Если же проявления гиперплазии волокон у человека имеют ограниченный характер, и она, гиперплазия, вносит существенный вклад в гипертрофию мышц только в накопительном режиме в рамках многолетнего тренировочного периода, то обнаружение проявлений гиперплазии после относительно короткого периода тренировок, ограниченного временными рамками эксперимента, окажется весьма проблематичным — в особенности с учётом ограниченности методов подсчёта волокон, применимых к человеку. Эксперименты, в которых гиперплазия мышц была обнаружена у животных, как правило, сопровождались умерщвлением подопытных животных и подсчётом полного числа волокон в мышцах. Так, в уже упомянутых экспериментах (W.J.Gonyea et al. 1977), (W.J.Gonyea et al. 1986) гиперплазия волокон была обнаружена благодаря сравнению полного числа волокон в мышцах, извлечённых из тренированной и нетренированной конечностей одного и того же животного. Понятно, что такие прямые методы обнаружения гиперплазии к человеку неприменимы.
Тем не менее, есть эксперименты, в которых проявления гиперплазии у человека исследовались близким методом. Подсчёт полного числа волокон в anterior tibialis левой и правой ног человека проводился в мышцах, изъятых из трупов предварительно здоровых молодых людей (M.Sjostrom et al. 1991). Мышцы доминирующей опорной конечности (левой для правшей) обладали несколько большим размером и большим числом волокон — при том, что среднее поперечное сечение волокон в мышцах обеих конечностей было одинаковым. Эти данные наиболее убедительно свидетельствуют в пользу того, что функциональная гипертрофия мышц человека, возможно, всё-таки связана с гиперплазией волокон (хотя тут нельзя исключать и изначальные генетические различия в мышцах доминирующей и не доминирующей конечностей).
В большинстве же случаев об изменении числа волокон у человека под воздействием тренировки приходится судить только на основе косвенных оценок, сделанных путём сопоставления размера мышцы и среднего поперечного сечения волокон в биопсиях, взятых из данной мышцы. Но результаты даже таких исследований весьма противоречивы.
Например, при сравнении мышц элитных бодибилдеров мужского и женского пола была обнаружена корреляция между размером мышцы и числом волокон в ней (S.E.Alway etal. 1989 a). Мышцы мужчин имели в среднем в два раза больший размер, чем мышцы женщин. Частично больший размер мышц мужчин объясняется большим поперечным сечением мышечных волокон в их мышцах, но в то же время мышцы мужчин имели и большее число волокон, чем мышцы женщин. Последнее может являться как следствием гиперплазии волокон, так и следствием генетических различий между полами. Сравнение проб, взятых из трицепса двух пауэрлифтёров международного уровня и пяти элитных культуристов, с пробами, взятыми из мышц представителей контрольной группы, практиковавших тренировки с отягощением только в течение шести месяцев, показало, что несмотря на большие различия в силе и обхвате рук между представителями элитной и контрольной групп не имелось никакого существенного различия в поперечном сечении мышечныхволокон (J.D.MacDougall et al. 1982). Эти данные подтверждает и исследование L.Larssonи P.A.Tesch, в котором обнаружилось, что поперечное сечение волокон в биопсиях, взятых из мышц бедра и бицепса четырёх бодибилдеров, не отличается от поперечного сечения волокон обычных физически активных людей (L.Larsson, P.A.Tesch 1986). Результаты данных исследований указывают на то, что больший объём мышц бодибилдеров связан с большим числом волокон в их мышцах. Объяснение этому феномену можно найти либо в генетически заложенном различие в числе мышечных волокон у элитных бодибилдеров и пауэрлифтёров, либо в гиперплазии волокон в результате тренировок. Генетическое объяснение кажется в данном случае наименее убедительным, поскольку из него должно следовать, что изначально спортсмены имели очень тонкие волокна и многолетние тренировки смогли привести лишь к тому, что их волокна достигли размера, характерного для обычного среднетренированного человека.
Исследования J.D.MacDougall с соавторами и L.Larsson с P.A.Tesch можно было бы считать надёжным свидетельством гиперплазии мышечных волокон у человека в результате тренировки, если бы не аналогичное, но более репрезентативноеисследование J.D.MacDougall с соавторами (J.D.MacDougall et al. 1984). В данном исследовании было выявлено количество волокон в мышцах бицепса пяти элитных культуристов, семи культуристов среднего уровня и тринадцати не специализировавшихся в бодибилдинге мужчин. Несмотря на то, что количество волокон в мышцах спортсменов сильно варьировало от индивида к индивиду и спортсмены с большим развитием мышц имели большее же число волокон в мышцах, авторы исследования пришли к выводу, что такие различия в числе волокон являются следствием генетической предрасположенности, а вовсе не гиперплазии, поскольку разброс числа волокон наблюдался внутри каждой группы, но среднее число волокон в мышцах представителей всех трёх групп кардинально не различалось.
Итак, совокупность экспериментальных фактов свидетельствует о том, что гиперплазия мышечных волокон у животных возможна и связана она, по-видимому, с повреждением мышечных волокон в результате функциональной перегрузки, пролиферацией клеток-сателлитов и последующими регенерационными процессами. Тем не менее, возможность гиперплазии мышц человека по-прежнему остаётся под вопросом. Возможно, регенерационный потенциал мышц человека не столь велик, чтобы микротравмирование волокон при тренировке могло вызвать их гиперплазию, но инъекционное применение таких стимуляторов клеточного деления, как гормон роста и анаболические стероиды, может значительно повысить регенерационные возможности мышц человека. Известно, что гормон роста через своего посредника — инсулиноподобный фактор роста (ИФР-1) — стимулирует пролиферацию слабо дифференцированных клеток — таких, как хондроциты, фибробластыи др. (М.И.Балаболкин 1998). Установлено, что ИФР-1 стимулирует пролиферацию и дальнейшее дифференцирование также и миосателлитоцитов (R.E.Allen, L.L.Rankin 1990),(G.E.McCall et al. 1998). Инъекции анаболических стероидов также стимулируют пролиферацию клеток-сателлитов (I.Sinha-Hikim et al. 2003). Не секрет, что профессиональные бодибилдеры нередко прибегают в своей практике к инъекциям гормона роста и анаболических стероидов, соответственно, деление и дифференцирование клеток-сателлитовдолжно происходить в их мышцах гораздо интенсивнее, чем у спортсменов, не применяющих данные препараты. Вопрос о том, может ли такая фармакологическая интенсификация активности миосателлитоцитов способствовать гиперплазии волокон у человека, требует дальнейшего изучения.
На данном же уровне имеющихся знаний о внутримышечных процессах, активируемых тренировкой, при построении новой и более адекватной концепции долговременной адаптации мышц к нагрузке необходимо ограничиться более общим заключением, которое можно считать достаточно обоснованным в ходе настоящего исследования: сколько-нибудьсущественная гипертрофия скелетных мышц человека под воздействием регулярной тренировки является следствием пролиферации клеток-сателлитов и увеличениясодержания ДНК в мышцах. Происходит ли увеличение содержания ДНК в мышцах только за счёт увеличения числа ядер в ранее существовавших волокнах, либо содержание ДНК в мышце увеличивается ещё и за счёт ядер вновь образованных мышечных волокон — всё это до окончательного решения вопроса о возможности гиперплазии мышечных волокон у человека можно специально не обговаривать.
Как показано в предпринятом выше анализе, гипертрофия и атрофия скелетных мышц в общем случае могут быть следствием как изменения интенсивности транскрипции мРНК в ядрах мышечных клеток, так и следствием изменения числа ядер в мышце — но при этом итоговый вклад данных факторов в результат двух антагонистичных адаптационных процессов весьма различен.
При развитии функциональной гипертрофии мышц доминирует следующая последовательность событий:
Увеличение нагрузки на мышцы —> активация пролиферации миосателлитоцитов —>увеличение числа ядер в мышце —> синтез РНК на новых ядрах —> синтез новых сократительных структур —> гипертрофия мышц
Снижение двигательной активности мышц, в свою очередь, активизирует вот какую последовательность событий, приводящих к атрофии мышц:
Снижение двигательной активности мышц —> снижение интенсивности транскрипции мРНК структурных белков и снижение пролиферативной активности миосателлитоцитов —> уменьшение размера ДНК-единицы и снижение числа ядер по мере их апоптоза —> атрофия мышц
Ввиду ограниченности размера ДНК-единицы изменение интенсивноститранскрипции мРНК структурных белков играет важную роль в процессах атрофии мышц, но не в процессах их гипертрофии. Вместе с тем следует отметить, что от интенсивноститранскрипции мРНК структурных белков зависит не только размер ДНК-единицы.Посредством управления интенсивностью экспрессии генов осуществляется регуляция спектра синтезируемых белков, что оказывает кардинальное влияние на функциональные свойства мышц.
Сравнение состава мышц крыс после компенсаторной гипертрофии, вызванной отсечением мышц-синергистов, и после функциональной гипертрофии, вызванной регулярным принудительным плаванием, показало, что компенсаторная гипертрофия сопровождается увеличением плотности митохондрий, уменьшением плотности миофибрилл и неизменностью плотности саркоплазматического ретикулума. В свою очередь, функциональная гипертрофия сопровождается увеличением плотности саркоплазматического ретикулума, а плотность митохондрий и миофибрилл остаётся неизменной (D.Seiden 1976).
В результате тренировок в мышцах может возрастать концентрация одних ферментов, обеспечивающих воспроизводство энергии, при неизменности концентрации других ферментов — в результате чего мышцы изменяют свои окислительные или гликолитическиевозможности (N.Wang et al. 1993).
Под воздействием тренировки возможно изменение характерных свойств мышечных волокон вплоть до изменения типа волокон (F.Ingjer 1979), (R.S.Staron et al. 1990), (N.Wang etal. 1993).
Изменения структуры и свойств мышц под воздействием тренировки не исчерпываются приведёнными выше примерами, но рассмотрение этих изменений не является темой настоящего исследования. Данные примеры были приведены лишь для того, чтобы показать, что изменения, происходящие с мышечными волокнами в результате тренировки, могут быть связаны с изменением белкового состава волокон, то есть могут являться следствием изменения интенсивности транскрипции мРНК различных видов структурных белков. Соответственно, воздействие тренировки на генетический аппарат мышечной клетки не может сводиться к усилению общего синтеза белка через общий для всех структурных белковфактор-регулятор. Более того, интенсификация синтеза некоторых видов сократительных белков происходит отнюдь не только при возрастании двигательной активности мышц. Так, снижение нагрузки на мышцы крыс, вызванное пребыванием животных в невесомости, снижает в ряде медленных волокон синтез цепей миозина, характерных для медленных волокон, но увеличивает экспрессию некоторых форм быстрого миозина (D.L.Allen et al 1996).Обратным образом, функциональная перегрузка мышц кошек снижает экспрессию некоторых форм быстрого миозина в медленных волокнах (D.L.Allen et al 1995). Эти факты не укладываются в концепцию прямого активирующего воздействия факторов энергетического истощения на экспрессию мРНК сократительных белков. Экспрессия мРНК сократительных белков мышц если и зависит от метаболических факторов, то зависимость эта проявляется, по-видимому, более сложным образом.
Как было отмечено в начале данного текста, часть спортивных исследователей отводит роль регулятора транскрипции мРНК сократительных белков мышц креатину, однако роль креатина в регуляции синтеза сократительных белков нельзя считать однозначно установленной. Действительно, в ряде исследований (J.S.Ingwall et al. 1972), (J.S.Ingwall etal. 1974), (M.L.Zilber et al. 1976) было показано, что повышение концентрации креатина интенсифицирует синтез специфических мышечных белков (миозина и актина) в развивающихся мышечных клетках in vitro. Эти наблюдения были восприняты как важное свидетельство того, что индуктором транскрипции сократительных белков является именно креатин. Однако впоследствии в противовес упомянутым выше исследованиям влияние креатина на синтез миозина обнаружено не было (D.M.Fry, M.F.Morales 1980), (R.B.Young,R.M.Denome 1984). R.B.Young и R.M.Denome предположили, что уровень креатина может регулировать синтез миозина лишь на ранних этапах эмбрионального развития мышечных клеток, но не может являться регулятором синтеза сократительных белков в уже сформированных мышечных волокнах.
Таким образом, гипотеза о роли креатина в регуляции синтеза сократительных белков требует дальнейшей проверки. Тем не менее, исходя из общих соображений, следует признать, что концепция, согласно которой индуктором транскрипции мРНК структурных белков является креатин или какой-либо иной фактор, связанный с истощением энергетики мышц, кажется достаточно убедительной лишь в отношении регуляции синтеза мышечных ферментов — если предположить, что регуляция ферментного синтеза в сложных многоклеточных организмах осуществляется по тому же принципу, что и у прокариот. Такие метаболилы, как АДФ, АМФ, ортофосфат, креатин и др., накапливающиеся в активно сокращающихся мышечных волокнах, сами являются субстратами для реакций, восстанавливающих запас энергетических фосфатов в волокне. Соответственно, накопление в мышцах указанных метаболилов должно стимулировать транскрипцию мРНК ферментов, которые обеспечивают протекание энерговосстанавливающих реакций, использующих данные метаболилы в качестве субстратов. Регулярная работа до утомления мышц должна сопровождаться регулярной активацией синтеза ферментов и в конечном итоге приводить к их накоплению в мышцах. Обратным образом, снижение двигательной активности мышц должно снижать частоту активирования синтеза мРНК ферментов. Соответственно, содержание в мышцах ферментов по мере естественного катаболизма последних должно убывать. Предположение, что накопление в мышцах ферментов происходит вследствие субстратно-индуцируемого усиления синтеза данных ферментов, выдвинул ещёН.Н.Яковлев (Н.Н.Яковлев 1974). Ф.З.Меерсон в обоснование гипотезы о влиянии ацидоза мышц на индукцию мРНК структурных белков привёл аргументы, которые также касаются индукции синтеза белков, ответственных именно за энергообеспечение мышц. Меерсон отметил, что ацидоз мышц является ранним сигналом энергетической недостаточности, и потому с позиций эволюционной теории оправданно будет предположить, что этот же сигнал вполне может использоваться в качестве активатора генетического аппарата клетки. В конечном итоге сие должно приводит к росту структур, которые призваны устранять дефицит энергии — и организм тем самым становится в целом более резистентными к изменившимся условиям внешней среды (Ф.З.Меерсон 1993).
Такую аргументацию можно признать весьма убедительной, но вот расширение данного принципа на регулирование синтеза иных видов мышечных белков, в особенности сократительных (как это происходит в концепции того же Меерсона и многих иных исследователей), кажется уже не совсем оправданным именно с эволюционной точки зрения. Высокая концентрация в саркоплазме продуктов распада макроэнергетических фосфатов является сигналом о том, что возможности мышечного волокна в восстановленииуровня АТФ за счёт окислительных процессов и гликолиза недостаточны для данной интенсивности сокращения. В такой ситуации адаптация мышечного волокна должна быть направлена в сторону увеличения мощности восстанавливающих энергию реакций. Синтез же сократительных белков (основных потребителей энергии) может способствовать лишь увеличению скорости расхода АТФ в волокне и приводить к ещё большему падениюуровня АТФ при новых аналогичных нагрузках — поэтому адаптация в данном направлении не может сделать мышечные волокна более устойчивыми к изменившейся требованиям в отношении двигательной активности мышц.
Таким образом, стимулы к развитию энергетики мышц и стимулы к экстенсивному развитию сократительного аппарата мышц должны иметь и, похоже, имеют разную природу.
Как уже было отмечено выше, совершенствование энергетических возможностей мышц тесно связано с увеличением содержания в мышцах ферментов, то есть является следствием субстратно-индуцируемого активирования транскрипции мРНК данных видов белка. Вполне вероятно, что синтез мРНК иных видов белка, связанных с энергообеспечением мышц (например, миоглобина или митохондриальных белков) может происходить по схожей схеме. Но, как показано выше, размер ДНК-единицы ограничен и каждое клеточное ядро ответственно за поддержание функционирования строго определённого объёма мышечного волокна. Для кардинального увеличения объёма мышц и строительства в них новых сократительных структур нужны новые клеточные ядра в дополнение к уже существующим, то есть экстенсивное развитие мышц связано в первую очередь с активацией пролиферацииклеток-сателлитов. Вместе с тем очевидно, что поскольку белковый состав сократительных структур различен для различных типов волокон и зависит от режима функционирования мышц, сигналы какого-то иного рода, воздействующие на генетический аппарат мышечных клеток, должны дополнительно регулировать спектр экспрессируемых сократительных белков.
Приведённый в настоящем тексте анализ показал, что общепринятая схема взаимосвязи звеньев срочной и долговременной адаптации мышц к нагрузке (см. рис. 2)
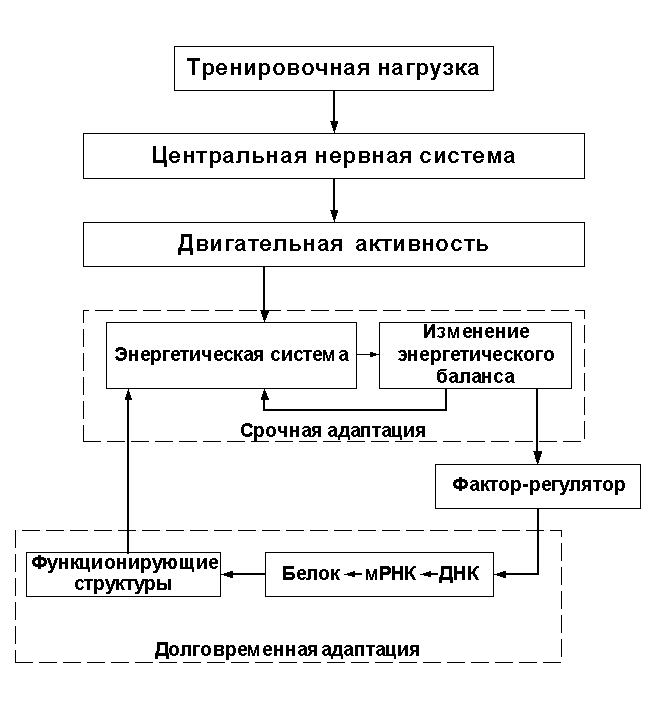
Рисунок 2
в отношении скелетных мышц описывает лишь часть адаптационных процессов, а именно — адаптацию энергетической системы мышц. Эта схема оставляет без внимания ряд важных механизмов долговременной адаптации скелетных мышц к нагрузке, а потому требует значительного уточнения (см. рис. 3).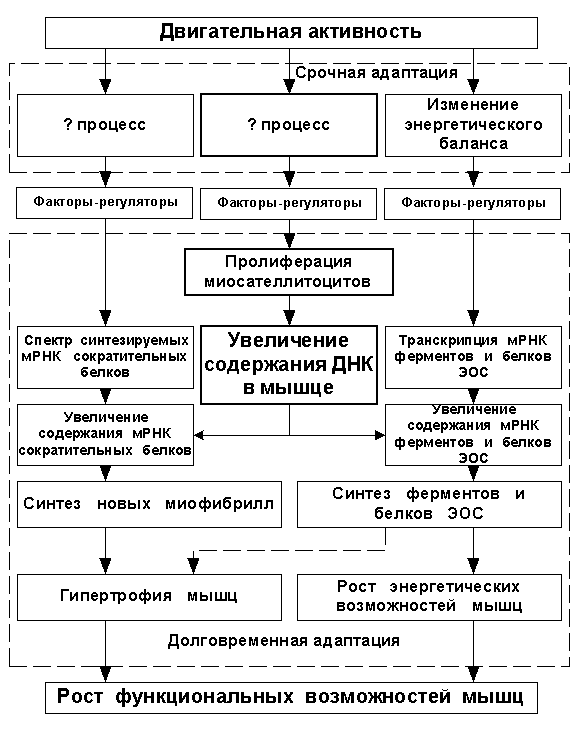
Рисунок 3 (ЭОС — энергообеспечивающие системы)
Следует отметить, что предлагаемая блок-схема механизмов адаптации мышц к нагрузке также не является исчерпывающей, поскольку не включает в себя достаточно важные механизмы гормональной адаптации организма к нагрузке — в ней учтены лишь основныелокальные (внутримышечные) адаптационные процессы, которые только и были предметом рассмотрения настоящего исследования.
Возникает вопрос: каковы последствия такого изменения принципиальной схемы адаптации для теории спортивной тренировки, то есть имеет ли для разработки тренировочных методик и планирования нагрузки значение то, за счёт каких именно процессов происходит адаптация мышц? Ответ на данный вопрос таков: да, судя по всему, изменение представлений о схеме адаптации мышц к нагрузке имеет немалое значение.
Дело в том, что интенсивная сократительная активность мышц блокирует синтез белка в мышцах и даже активизирует его катаболизм. Следовательно, рациональным следует считать такой режим тренировок, при котором новое тренировочное занятие сочетается по времени с отключением адаптивного синтеза белка после предыдущего тренировочного занятия или же со значительным снижением его интенсивности (А.А.Виру,Н.Н.Яковлев 1988). Если при реализации данного принципа исходить из того, что тренировочное воздействие сводится лишь к активированию транскрипции мРНКструктурных белков под воздействием единого фактора-регулятора, то максимальный эффект будет иметь место в результате применения крайне простой тренировочной схемы со следующими друг за другом через равные интервалы отдыха тренировочными занятиями, интенсивность которых возрастает по мере тренированности организма. Однако, к сожалению, из спортивной практики хорошо известна малая эффективность такого рода тренировочных методик, в особенности для хорошо тренированных спортсменов.
Из предложенной в настоящем тексте схемы развития долговременной адаптации скелетных мышц (см. рис. 3) видно, что адаптивное усиление синтеза белка связано не только с процессами активирования транскрипции мРНК структурных белков, но и с увеличением объёма синтезированного белка за счёт синтеза белка на мРНК, экспрессируемыхновообразованными ДНК. Причём посттренировочное активирование транскрипции мРНКиграет наиболее важную роль в регуляции синтеза белков, связанных с энергообеспечением мышц. Для повышения энергетических возможностей мышц тренировочные занятия, активирующие транскрипцию мРНК белков энергообеспечивающих систем, следует проводить в такой период, когда адаптивный синтез данных белков, вызванный предыдущим тренировочным занятием, близок к завершению или, во всяком случае, прошёл фазу наивысшей активности.
Адаптивное же усиление синтеза белка за счёт мРНК, экспрессируемых новообразованными ядрами, можно считать завершённым только тогда, когда завершено строительство новых сократительных структур на основе новообразованных ядер, то есть когда в мышцах после увеличения числа ядер восстановлен характерныйразмер ДНК-единицы. Строительство сократительных структур с нуля в отличие от синтеза ферментов — процесс весьма длительный, поэтому оптимальная частота тренировочных занятий, активирующих пролиферацию миосателлитоцитов, может кардинально отличаться от оптимальной частоты тренировок, обеспечивающей максимальный синтез белков энергообеспечивающих систем мышц.
В предлагаемой блок-схеме локальных механизмов долговременной адаптации скелетных мышц два блока отмечены знаком вопроса, а факторы-регуляторы не определены. Как уже отмечалось выше, факторами-регуляторами синтеза ферментов являются продукты энергетического метаболизма, а вот совокупность факторов, влияющих на спектр экспрессируемых сократительных белков, а также факторы, активирующие пролиферацию миосателлитоцитов, до настоящего времени в полной мере не установлены. Продвижение исследований в данных направлениях позволит в будущем разработать более специализированные методы тренировки, направленно стимулирующие различные адаптационные процессы в мышцах. В свою очередь, более чёткое разделение тренировочного воздействия позволит оптимизировать дозирование нагрузки в тренировочном микроцикле.
Литература:
1. Аракелян Е.Е., Збарский В.А., Шевченко Т.Н., Селуянов В.Н. "Формирование техники спринтерского бега посредством направленного развития силы отдельных мышечных групп у юных атлетов" Физическая культура: воспитание, образование, тренировка. 1997 г. № 3 2. Березов Т.Т., Коровкин Б.Ф. "Биологическая химия" Изд. "Медицина" Москва 1998 г. 704 стр. 3. Балаболкин М.И. "Эндокринология" Москва "Универсум паблишинг" 1998 г. 4. Виру А.А., Яковлев Н.Н. "Главы из спортивной физиологии" Изд. Тартуского государственного университета. Тарту 1988 г. 134 стр. 5. Волков Н.И., Нессен Э.Н., Осипенко А.А., Корсун С.Н. "Биохимия мышечной деятельности" Изд. "Олимпийская литература" Киев 2000 г. 503 стр. 6. Володина А.В. "Посттравматическая регенерация скелетных мышц" Диссертация доктора биологических наук. Москва 1995 г. 7. Данилов Р.К. "Очерки гистологии мышечных тканей" Уфа 1994 г. 49 стр. 8. Калинский М.И., Курский М.Д., Осипенко А.А. "Биохимические механизмы адаптации при мышечной деятельности" Киев. Изд. "Выща школа" 1986 г. 183 стр. 9. Мак-Комас А.Дж. "Скелетные мышцы" Изд. "Олимпийская литература" Киев 2001 г. 407 стр. 10. Меерсон Ф.З "Адаптационная медицина: концепция долговременной адаптации" Москва. Изд. "Дело" 1993 г. 138 стр. 11. Меерсон Ф.З. Пшенникова М.Г. "Адаптация к стрессовым ситуациям и физическим нагрузкам" Москва. Изд. "Медицина" 1988 г. 253 стр. 12. Селуянов В.Н. "Разработка методов и планов физической подготовки спортсменов на основе имитационного моделирования" Из сборника "Теория и практика применения дидактики развивающего обучения в подготовке специалистов по физическому воспитанию" Изд. "Физкультура, образование и наука". Труды сотрудников проблемной научно-исследовательской лаборатории / Научный руководитель В.Н.Селуянов. — М: Физкультура, образование и наука, 1996. — 106 стр. 13. Сингер М., Берг П. "Гены и геномы" в 2-х томах Изд. "Мир" Москва 1998г. 764 стр. 14. Улумбеков Э.Г., Челышев Ю.А. "Гистология, введение в патологию", Москва "ГЕОТАР Медицина" 1998 г. 15. Шекман Б.С. "Влияние тренировки на композицию мышц, размер и окислительный потенциал мышечных волокон у человека" Диссертационная работа. Москва 1990 г. 16. Шубникова Е.А., Юрина Н.А., Гусев Н.Б., Балезина О.П., Большакова Г.Б. "Мышечные ткани" Москва "Медицина" 2001 г. 17. Яковлев Н.Н. "Биохимия спорта" Изд. "Физкультура и спорт". Москва 1974 г. 288 стр. 18. Яковлев Н.Н., Коробков А.В., Янанис С.В. "Физиологические и биохимические основы теории и методики спортивной тренировки" Изд. "Физкультура и спорт". Москва 1957 г. 323 стр. 19. Allen DL, Linderman JK, Roy RR, Bigbee AJ, Grindeland RE, Mukku V, Edgerton VR (1997) "Apoptosis: a mechanism contributing to remodeling of skeletal muscle in response to hindlimb unweighting" Am J Physiol. 1997 Aug; 273(2 Pt 1):C579-87. 20. Allen DL, Monke SR, Talmadge RJ, Roy RR, Edgerton VR (1995) "Plasticity of myonuclear number in hypertrophied and atrophied mammalian skeletal muscle fibers" J Appl Physiol 78: 1969-1976, 1995; 21. Allen DL, Yasui W, Tanaka T, Ohira Y, Nagaoka S, Sekiguchi C, Hinds WE, Roy RR, Edgerton VR (1996) "Myonuclear number and myosin heavy chain expression in rat soleus single muscle fibers after spaceflight" J Appl Physiol. 1996 Jul;81(1):145-51. 22. Allen RE, Rankin LL (1990) "Regulation of satellite cells during skeletal muscle growth and development" Proc Soc Exp Biol Med. 1990 Jun;194(2):81-6. 23. Alway SE, Grumbt WH, Gonyea WJ, Stray-Gundersen J (1989a) "Contrasts in muscle and myofibers of elite male and female bodybuilders" J Appl Physiol. 1989 Jul;67(1):24-31 24. Alway SE, Winchester PK, Davis ME, Gonyea WJ (1989b) "Regionalized adaptations and muscle fiber proliferation in stretch-induced enlargement" J Appl Physiol. 1989 Feb;66(2):771-81. 25. Antonio J, Gonyea WJ (1993 a) "Role of muscle fiber hypertrophy and hyperplasia in intermittently stretched avian muscle" J Appl Physiol. 1993 Apr;74(4):1893-8 26. Antonio J, Gonyea WJ (1993 b) "Progressive stretch overload of skeletal muscle results in hypertrophy before hyperplasia" J Appl Physiol. 1993 Sep;75(3):1263-71. 27. Appell HJ, Forsberg S, Hollmann W (1988) "Satellite cell activation in human skeletal muscle after training: evidence for muscle fiber neoformation" Int J Sports Med. 1988 Aug;9(4):297-9. 28. Bruusgaard JC, Liestol K, Ekmark M, Kollstad K, Gundersen K (2003) "Number and spatial distribution of nuclei in the muscle fibres of normal mice studied in vivo" J Physiol. 2003 Sep 1;551(Pt 2):467-78. Epub 2003 Jun 17. 29. Burleigh IG (1977) "Observations on the number of nuclei within the fibres of some red and white muscles" J Cell Sci. 1977 Feb;23:269-84. 30. Cabric M, Appell HJ, Resic A (1987) "Effects of electrical stimulation of different frequencies on the myonuclei and fiber size in human muscle" Int J Sports Med. 1987 Oct;8(5):323-6. 31. Cabric M, James NT (1983) "Morphometric analyses on the muscles of exercise trained and untrained dogs" Am J Anat.166(3):359-68. 32. Cheek DB (1985) "The control of cell mass and replication. The DNA unit — a personal 20-year study" Early Hum Dev. 1985 Dec;12(3):211-39. 33. Darr KC, Schultz E (1987) "Exercise-induced satellite cell activation in growing and mature skeletal muscle" J Appl Physiol. 1987 Nov;63(5):1816-21 34. Dmitrieva EV (1975) "The role of the buds and myoblasts in reparative regeneration of muscle fibers of the skeletal type" Arkh Anat Gistol Embriol. 1975 Feb;68(2):37-43. 35. Enesco M, Puddy D "Increase in the number of nuclei and weight in skeletal muscle of rats of various ages" (1964) Amer . J. Anat.114:235 36. Fry DM, Morales MF (1980) "A reexamination of the effects of creatine on muscle protein synthesis in tissue culture" J Cell Biol. 1980 Feb;84(2):294-7. 37. Giddings CJ, Gonyea WJ (1992) "Morphological observations supporting muscle fiber hyperplasia following weight-lifting exercise in cats" Anat Rec.1992 Jun;233(2):178-95 38. Gollnick PD, Timson BF, Moore RL, Riedy M (1981) "Muscular enlargement and number of fibers in skeletal muscles of rats" J Appl Physiol. 1981 May;50(5):936-43. 39. Gollnick PD, Parsons D, Riedy M, Moore RL (1983) "Fiber number and size in overloaded chicken anterior latissimus dorsi muscle" J Appl Physiol. 1983 May;54(5):1292-7. 40. Gonyea W, Ericson GC, Bonde-Petersen F "Skeletal muscle fiber splitting induced by weight-lifting exercise in cats" Acta Physiol Scand. 1977 Jan;99(1):105-9. 41. Gonyea WJ, Sale DG, Gonyea FB, Mikesky A (1986) "Exercise induced increases in muscle fiber number" Eur J Appl Physiol Occup Physiol. 1986;55(2):137-41. 42. Gustafsson JA, Saartok T, Dahlberg E, Snochowski M, Haggmark T, Eriksson E (1984) "Studies on steroid receptors in human and rabbit skeletal muscle — clues to the understanding of the mechanism of action of anabolic steroid" Prog Clin Biol Res. 1984;142:261-90 43. Ingjer F (1979) "Effects of endurance training on muscle fibre ATP-ase activity, capillary supply and mitochondrial content in man" J Physiol. 1979 Sep;294:419-32. 44. Ingwall JS, Morales MF, Stockdale FE (1972) "Creatine and the control of myosin synthesis in differentiating skeletal muscle" Proc Natl Acad Sci USA. 1972 Aug;69(8):2250-3. 45. Ingwall JS, Weiner CD, Morales MF, Davis E, Stockdale FE (1974) "Specificity of creatine in the control of muscle protein synthesis" J Cell Biol. 1974 Jul;62(1):145-51 46. James NT, Cabric M (1981) "Quantitative studies on the numerical frequency of myonuclei in the muscles of exercised rats: evidence against the occurrence of fibre-splitting" Br J Exp Pathol. 1981 Dec;62(6):600-5. 47. Kadi F, Eriksson A, Holmner S, Butler-Browne GS, Thornell LE (1999а) "Cellular adaptation of the trapezius muscle in strength-trained athletes" Histochem Cell Biol. 1999 Mar;111(3):189-95. 48. Kadi F, Eriksson A, Holmner S, Thornell LE (1999b) "Effects of anabolic steroids on the muscle cells of strength-trained athletes" Med Sci Sports Exerc. 1999 Nov;31(11):1528-34. 49. Kasper CE, Xun L (1996) "Cytoplasm-to-myonucleus ratios in plantaris and soleus muscle fibres following hindlimb suspension" J Muscle Res Cell Motil. 1996 Oct;17(5):603-10 50. Kelly FJ, Lewis SE, Anderson P, Goldspink DF (1984) "Pre- and postnatal growth and protein turnover in four muscles of the rat" Muscle Nerve. 1984 Mar-Apr;7(3):235-42. 51. Kennedy JM, Eisenberg BR, Reid SK, Sweeney LJ, Zak R (1988) "Nascent muscle fiber appearance in overloaded chicken slow-tonic muscle" Am J Anat. 1988 Feb;181(2):203-15. 52. Kondalenko VF, Sergeev IP, Ivanitskaia VV (1981) "Electron microscopic study of signs of skeletal muscle fiber hyperplasia in athletes" Arkh Anat Gistol Embriol. 1981 Jun;80(6):66-70. 53. Larsson L., Tesch PA (1986) "Motor unit fiber density in extremely hypertriphied skeletal muscles in man" Eur J Appl Physiol Occup Physiol. 1986;55(2):130-6. 54. MacDougall JD, Sale DG, Elder GC, Sutton JR (1982) "Muscle ultrastructural characteristics of elite powerlifters and bodybuilders" Eur J Appl Physiol Occup Physiol. 1982;48(1):117-26. 55. MacDougall JD, Sale DG, Alway SE, Sutton JR (1984) "Muscle fiber number in biceps brachii in bodybuilders and control subjects" J Appl Physiol. 1984 Nov;57(5):1399-403. 56. Manta P, Vassilopoulos D, Spengos M (1987) "Nucleo-cytoplasmic ratio in ageing skeletal muscle" Eur Arch Psychiatry Neurol Sci. 1987;236(4):235-6. 57. Mauro A (1961) "Satellite cell of skeletal muscle fibers" J Biophys Biochem Cytol 9: 493-498, 1961 58. McCall, GE, Allen DL, Linderman JK, Grindeland RE, Roy RR, Mukku VR, and Edgerton VR (1998) "Maintenance of myonuclear domain size in rat soleus after overload and growth hormone/IGF-I treatment" J Appl Physiol 84: 1407-1412, 1998 59. McCall GE, Byrnes WC, Dickinson A, Pattany PM, Fleck SJ (1996) "Muscle fiber hypertrophy, hyperplasia, and capillary density in college men after resistance training" J Appl Physiol. 1996 Nov;81(5):2004-12. 60. McCormick KM, Thomas DP (1992) "Exercise-induced satellite cell activation in senescent soleus muscle" J Appl Physiol. 1992 Mar;72(3):888-93. 61. Moss FP (1968) "The relationship between the dimensions of the fibers and the number of nuclei during normal growth of skeletal muscle in the domestic fowl" Amer. J. Anat. 122:555. 62. Moss FP, Leblond CP (1970) "Nature of dividing nuclei in skeletal muscle of growing rats" J Cell Biol. 44(2):459-62. 63. Mozdziak PE, Schultz E, Cassens RG (1997) "Myonuclear accretion is a major determinant of avian skeletal muscle growth" Am J Physiol. 1997 Feb;272(2Pt1):C565-71. 64. Mozdziak PE, Pulvermacher PM, Schultz E (2000) "Unloading of juvenile muscle results in a reduced muscle size 9 wk after reloading" J Appl Physiol 88:158-164, 2000 65. Musacchia XJ, Deavers DR, Meininger GA, Davis TP (1980) "A model for hypokinesia: effects on muscle atrophy in the rat" J Appl Physiol. 1980 Mar;48(3):479-86. 66. Ogilvie RW, Armstrong RB, Baird KE, Bottoms CL (1988) "Lesions in the rat soleus muscle following eccentrically biased exercise" Am J Anat. 1988 Aug; 182(4):335-46. 67. Ohira Y, Yoshinaga T, Ohara M, Nonaka I, Yoshioka T, Yamashita-Goto K, Shenkman BS, Kozlovskaya IB, Roy RR, Edgerton VR (1999) "Myonuclear domain and myosin phenotype in human soleus after bed rest with or without loading" J Appl Physiol. 1999 Nov;87(5):1776-85 68. Pacy PJ, Evans RH, Halliday D (1987) "Effect of anaerobic and aerobic exercise promoted by computer regulated functional electrical stimulation (FES) on muscle size, strength and histology in paraplegic males" Prosthet Orthot Int. 1987 Aug;11(2):75-9. 69. Pavlath GK, Rich K, Webster SG, Blau HM (1989) "Localization of muscle gene products in nuclear domains" Nature. 1989 Feb 9;337(6207):570-3. 70. Pullman WE, Yeoh GC (1977) "The role of myonuclei in muscle regeneration: an in vitro study" J Cell Physiol. 1978 Aug;96(2):245-51. 71. Ralston E, Hall ZW (1992) "Restricted distribution of mRNA produced from a single nucleus in hybrid myotubes" The Journal of Cell Biology, Vol 119, 1063-1068 72. Rayne J, Crawford GN (1975) "Increase in fibre numbers of the rat pterygoid muscles during postnatal growth" J Anat. 1975 Apr;119(2):347-57. 73. Rosenblatt JD, Yong D, Parry DJ (1994) "Satellite cell activity is required for hypertrophy of overloaded adult rat muscle" Muscle Nerve. 1994 Jun;17(6):608-13. 74. Roth SM, Martel GF, Ivey FM, Lemmer JT, Tracy BL, Metter EJ, Hurley BF, Rogers MA (2001) "Skeletal muscle satellite cell characteristics in young and older men and women after heavy resistance strength training" J Gerontol A Biol Sci Med Sci. 2001 Jun;56(6):B240-7. 75. Roy RR, Monke SR, Allen DL, Edgerton VR (1999) "Modulation of myonuclear number in functionally overloaded and exercised rat plantaris fibers" J Appl Physiol. 1999 Aug;87(2):634-42. 76. Salleo A, Anastasi G, La Spada G, Falzea G, Denaro MG (1980) "New muscle fiber production during compensatory hypertrophy" Med Sci Sports Exerc. 1980;12(4):268-73. 77. Seiden D (1976) "Quantitative analysis of muscle cell changes in compensatory hypertrophy and work-induced hypertrophy" Am J Anat. 1976 Apr;145(4):459-65. 78. Sinha-Hikim I, Roth SM, Lee MI, Bhasin S (2003) "Testosterone-induced muscle hypertrophy is associated with an increase in satellite cell number in healthy, young men" Am J Physiol Endocrinol Metab 285: E197-E205, 2003. First published April 1, 2003 79. Sjostrom M, Lexell J, Eriksson A, Taylor CC (1991) "Evidence of fibre hyperplasia in human skeletal muscles from healthy young men? A left-right comparison of the fibre number in whole anterior tibialis muscles" Eur J Appl Physiol Occup Physiol. 1991;62(5):301-4. 80. Smith HK, Maxwell L, Martyn JA, Bass JJ (2000) "Nuclear DNA fragmentation and morphological alterations in adult rabbit skeletal muscle after short-term immobilization" Cell Tissue Res. 2000 Nov;302(2):235-41. 81. Snow MH (1977) "Myogenic cell formation in regenerating rat skeletal muscle injured by mincing. II. An autoradiographic study" Anat Rec. 1977 Jun;188(2):201-17 82. Snow MH (1990) "Satellite cell response in rat soleus muscle undergoing hypertrophy due to surgical ablation of synergists" Anat Rec. 1990 Aug;227(4):437-46. 83. Snow MH, Chortkoff BS (1987) "Frequency of bifurcated muscle fibers in hypertrophic rat soleus muscle" Muscle Nerve. 1987 May;10(4):312-7. 84. Staron RS, Malicky ES, Leonardi MJ, Falkel JE, Hagerman FC, Dudley GA (1990) "Muscle hypertrophy and fast fiber type conversions in heavy resistance-trained women" Eur J Appl Physiol Occup Physiol. 1990; 60 (1):71-9 85. Tamaki T, Akatsuka A, Tokunaga M, Ishige K, Uchiyama S, Shiraishi T (1997) "Morphological and biochemical evidence of muscle hyperplasia following weight-lifting exercise in rats" Am J Physiol. 1997 Jul;273(1 Pt 1):C246-56. 86. Tamaki T, Akatsuka A, Yoshimura S, Roy RR, Edgerton VR (2002) "New fiber formation in the interstitial spaces of rat skeletal muscle during postnatal growth" J Histochem Cytochem. 2002 Aug;50(8):1097-111 87. Tamaki T, Uchiyama S, Nakano S (1992) "A weight-lifting exercise model for inducing hypertrophy in the hindlimb muscles of rats" Med Sci Sports Exerc. 1992 Aug;24(8):881-6. 88. Timson BF, Bowlin BK, Dudenhoeffer GA, George JB (1985) "Fiber number, area, and composition of mouse soleus muscle following enlargement" J Appl Physiol. 1985 Feb;58(2):619-24. 89. Tseng BS, Kasper CE, Edgerton VR (1994) "Cytoplasm-to-myonucleus ratios and succinate dehydrogenase activities in adult rat slow and fast muscle fibers" Cell Tissue Res. 1994 Jan;275(1):39-49 90. Vassilopoulos D, Lumb EM, Emery AE (1977) "Karyometric changes in human muscle with age" Eur Neurol. 1977;16(1-6):31-4. 91. Wang N, Hikida RS, Staron RS, Simoneau JA (1993) "Muscle fiber types of women after resistance training — quantitative ultrastructure and enzyme activity" Pflugers Arch. 1993 Sep;424(5-6):494-502. 92. Winchester PK, Davis ME, Alway SE, Gonyea WJ (1991) "Satellite cell activation in the stretch-enlarged anterior latissimus dorsi muscle of the adult quail" Am J Physiol Cell Physiol 260: C206-C212, 1991 93. Winchester PK, Gonyea WJ (1992) "Regional injury and the terminal differentiation of satellite cells in stretched avian slow tonic muscle" Dev Biol. 1992 Jun;151(2):459-72 94. Young RB, Denome RM (1984) "Effect of creatine on contents of myosin heavy chain and myosin-heavy-chain mRNA in steady-state chicken muscle-cell cultures" Biochem J. 1984 Mar 15;218(3):871-6. 95. Zilber ML, Litvinova VN, Morozov VI, Pliskin AV, Pshendin AI, Rogozkin VA (1976) "The creatine effect on RNA and protein synthesis in growing culture of chick embryo myoblasts" Biokhimiia. 1975 Jul-Aug;40(4):854-60
Автор: В.А.Протасенко
Установлено, что физическая нагрузка угнетает синтез белка в мышечной ткани непосредственно во время упражнения и активизирует катаболизм белка в начальный восстановительный период (Н.Н.Яковлев 1974), (А.А.Виру, Н.Н.Яковлев 1988).Следовательно, функциональная гипертрофия мышц происходит именно за счёт активизации синтеза белка, но никак не в результате снижения интенсивности распада белка при сохранении прежнего уровня интенсивности синтеза белка.
Тем не менее, сами механизмы воздействия тренировки на интенсивность синтеза белка в мышцах до настоящего времени в достаточно полной мере ещё не изучены.
Регуляция синтеза белка на уровне транскрипции мРНК
Интенсивность синтеза белка может зависеть от множества факторов и регулироваться на всех этапах его биосинтеза. Однако ключевым этапом регуляции белкового синтеза считается этап транскрипции мРНК — первый этап биосинтеза белка, в ходе которого происходит считывание с ДНК ядра клетки информации о последовательности аминокислот в белковой молекуле и запись этой информации в молекуле матричной РНК, на основе которой затем в цитоплазме клетки осуществляется сборка белковой молекулы.
Согласно общепринятой на сегодня концепции Ф.Жакоба и Ж.Моно (излагается по Т.Т.Берёзов и Б.Ф.Коровкин 1998, М.Сингер и П.Берг 1998), в молекуле ДНК имеются не только структурные гены (то есть те гены, которые кодируют белки, обеспечивающие функционирование клетки), но также и гены, регулирующие активность самих структурных генов — то есть так называемые "гены-операторы" и "гены-регуляторы" (см. рис. 1).

Рисунок 1
Комплекс генов, состоящий из гена-оператора и одного или нескольких структурных генов, экспрессия (то есть процесс активизации транскрипции мРНК на данном гене и синтезготовой мРНК) которых регулируется совместно, называется опероном. Транскрипция мРНК на структурных генах оперона возможна лишь тогда, когда ген-оператор находится в активном состоянии. На ген-оператор могут воздействовать специфические белки, экспрессируемые геном-регулятором, которые могут как блокировать ген-оператор (в этом случае регуляторный белок называется репрессором, а схема регуляции называется отрицательной регуляцией), так и активировать ген-оператор (в этом случае регуляторный белок называется активатором транскрипции, а схема регуляции называется положительной регуляцией).
В свою очередь, регуляторные белки подвержены влиянию определённых низкомолекулярных веществ, которые при соединении с регуляторным белком изменяют его структуру так, что тот либо получает возможность связаться с геном-оператором, либо возможность связывания белка-регулятора с геном-оператором блокируется. Набор регуляторных белков, а также низкомолекулярных веществ, индуцирующих или ингибирующих транскрипцию мРНК, индивидуален для каждого оперона и до настоящего времени для большинства генов человека в точности не определён.
Наиболее полно изучена регуляция транскрипции ферментов в клетках прокариот, то есть простейших безъядерных одноклеточных живых существ. Как правило, индукторами транскрипции мРНК того или иного фермента у прокариот выступают субстраты — исходные вещества, подвергающиеся в клетке определённым превращениям под действием фермента. А продукты протекающих в клетке химических реакций, являющиеся результатом переработки субстратов, могут выполнять роль ингибиторов транскрипции мРНК фермента. Таким образом, при появлении в клетке субстратов, требующих дальнейшей переработки, индуцируется синтез ферментов, осуществляющих такую переработку, а при снижении концентрации субстратов и накоплении продуктов реакции транскрипция фермента блокируется.
Например, если бактерии E.coli попадают в раствор глюкозы, то они приспосабливаются к перевариванию именно глюкозы, то есть ферменты, расщепляющие более сложные углеводы, у этих бактерий не вырабатываются. Если же глюкозу в питательном растворе заменить молочным сахаром — лактозой, то E.coli некоторое время не могут питаться и размножаться, поскольку ген лактазы — фермента, расщепляющего лактозу на глюкозу и галактозу, блокирован у данных бактерий белком-репрессором, и они не синтезируют данный фермент. Однако уже через некоторое время после замены питательной среды лактоза, поглощаемая бактериями E.coli, соединяется с белком-репрессором гена, кодирующего лактазу, и репрессор теряет способность связываться с ДНК и перестает блокировать синтез мРНК лактазы. В результате таких процессов в бактериальной клетке активируется синтез нужного фермента, бактерии получают возможность переваривать молочный сахар, и снова начинают размножаться. При этом белок-репрессор продолжает постоянно вырабатываться бактериальной клеткой, но новые молекулы лактозы связываются с репрессором и инактивируют его. Как только бактерии переработают всю лактозу, инактивирование белка-респрессора лактозой становится невозможным и активный репрессор вновь блокирует ген, кодирующий лактазу — фермент, потребность в котором уже отпала. Таков механизм, благодаря которому через активность генов регулируется адаптивная реакция клетки на изменение условий её существования.
Регуляция транскрипции в клетках эукариот, то есть живых существ, клетки которых имеют ядра, может происходить по принципиально схожим, но гораздо более сложным схемам, так как процессы транскрипции мРНК и сборки на её основе белковой молекулы разобщены как мембраной ядра, так и временным интервалом (у эукариот синтез мРНК происходит в ядре клетки, а сборка белковой молекулы осуществляется вне ядра, непосредственно в цитоплазме). В многоклеточных организмах преобладает положительная регуляция активности генов, и для каждого оперона имеется не менее пяти участков ДНК, с которыми должно произойти связывание специфических белков-регуляторов для того, чтобы началась транскрипция структурных генов данного оперона. Для ряда оперонов в качестве индукторов транскрипции мРНК могут выступать стероидные гормоны.
Современная концепция воздействия физической нагрузки на интенсивность синтеза белка клеткой
При моделировании воздействия тренировочной нагрузки на функциональное состояние мышц в целом и на их гипертрофию в частности современная спортивная теория опирается на концепцию срочной и долговременной адаптации мышц к нагрузке (Калинскийи др. 1986), (А.А.Виру, Н.Н.Яковлев 1988), (Ф.З.Меерсон, М.Г.Пшенникова 1988),(Ф.З.Меерсон 1993), которая уже вошла в учебники (Н.И.Волков и др. 2000). Согласно данной концепции, физическая нагрузка вызывает существенные изменения во внутренней среде мышц, и изменения эти связаны, в основном, с нарушением энергетического баланса (то есть со снижением содержания в мышцах АТФ, креатинфосфата, гликогена, а также с накоплением продуктов энергетического метаболизма — АДФ, АМФ, свободного креатина, ортофосфата, молочной кислоты и др.). Указанные изменения во внутренней среде мышц стимулируют процессы адаптации организма к новым условиям существования.
Первичная реакция организма на нагрузку, получившая название срочной адаптационной реакции, сводится, в основном, к изменению энергетического обмена в мышцах и организме в целом, а также к изменениям в системе его вегетативного обслуживания. В ходе срочных адаптационных процессов в мышцах накапливаются вещества, активирующие транскрипцию мРНК структурных генов либо непосредственно, либо через индукцию синтеза белков-регуляторов, управляющих активностью генов структурных белков мышц. При повторяющихся тренировочных нагрузках, благодаря регулярной активации генетического аппарата мышечных клеток, в мышцах увеличивается содержание структурных белков, вследствие чего мышцы становятся более резистентными к задаваемой нагрузке — именно таким образом в мышцах и развивается долговременная адаптация. Принципиальная схема взаимосвязи звеньев срочной и долговременной адаптации изображена на рисунке 2 (позаимствовано из работы Калинского и др. 1986,Н.И.Волкова и др. 2000).
В качестве первичной причины, запускающей механизмы воздействия на генетический аппарат мышечной клетки и в конечном итоге активирующей синтез мРНК структурных белков, чаще всего рассматривается истощение внутриклеточных энергетических ресурсов, уменьшение в саркоплазме концентрации АТФ и креатинфосфата и возрастание содержания АДФ, АМФ и креатина.
Ф.З.Меерсон отмечает, что то, какой именно внутриклеточный сигнал оказывает непосредственное воздействие на генетический аппарат клетки, достоверно не установлено, и в качестве гипотезы выдвигает на роль данного первичного сигнала повышение в саркоплазме концентрации ионов водорода — то есть ацидоз мышц, вызванный накоплением кислых продуктов метаболизма (Ф.З.Меерсон 1993). В концепции долговременной адаптации Меерсона ацидоз воздействует на синтез мРНК структурных белков не непосредственно, а через активацию протоонкогенов c-myc и c-foc — ранних генов, экспрессирующих регуляторные белки, которые, в свою очередь, активируют гены структурных белков.
Ряд спортивных методистов при обосновании своих тренировочных концепций также рассматривают ацидоз мышц как важный фактор запуска белкового синтеза — однако с их точки зрения, ацидоз оказывает своё влияние на активность генетического аппарата клетки через облегчение доступа других факторов транскрипции к наследственной информации(В.Н.Селуянов 1996), (Е.Е.Аракелян и др. 1997). Последнее, по мнению упомянутых авторов, достигается посредством увеличения проницаемости клеточных мембран, в том числе ядерных мембран, раскручивания спирали ДНК и ряда других процессов, активизирующихся в клетке при повышении концентрации H+. Прямое же воздействие на ДНК клетки, индуцирующее синтез сократительных белков, согласно мнению этих же авторов, оказывает креатин, концентрация которого возрастает в саркоплазме работающих мышц вследствие интенсивного восстановления АТФ за счёт креатинфосфата. На креатин как на фактор-активатор белкового синтеза указывается и в современных учебных пособиях по биохимии спорта (Н.И.Волков и др. 2000).
Принципиально схожая концепция регуляции белкового синтеза рассмотрена Дж.Мак-Комасом — с тем лишь отличием, что в роли спускового механизма, включающего транскрипцию мРНК сократительных белков мышц, в данной концепции выступают не ассоциируемые с утомлением мышц факторы, а механическое растяжение волокон, возникающее в процессе двигательной активности мышц (А.Дж.Мак-Комас 2001).Предполагается, что напряжение цитоскелета мышечных волокон, в особенности во время эксцентрической фазы движения (то есть при удлинении напряжённого мышечного волокна под действием внешней силы), вызывает высвобождение ряда факторов (возможно, включая простагландины), активирующих индукцию ранних генов, белки которых, в свою очередь, активируют гены сократительных белков мышц.
Увеличенное механическое напряжение сердечной мышцы при повышении кровяного давления в качестве возможного фактора, активизирующего экспрессию регуляторных генов в кардиомиоцитах, рассматривает и Меерсон. Однако последний ввиду того, что механические факторы влияют на активность регуляторных генов только в бьющемся, в работающем сердце, склоняется к превалированию именно метаболических факторов в активации регуляторных генов (Ф.З.Меерсон 1993). По мнению Меерсона, гипертрофия сердечной мышцы при повышении механического напряжения развивается по следующей схеме:
Нагрузка —> увеличение механической активности —> дефицит энергии —> снижение pH —> активация экспрессии протоонкогенов —> синтез белков-регуляторов —> активация синтеза сократительных белков —> компенсаторная гипертрофия.
Таким образом, в настоящее время среди исследователей нет единого мнения о том, какие именно процессы, сопровождающие физическую нагрузку, выполняют роль спускового механизма транскрипции мРНК структурных белков мышц. Объединяет же все приведённые выше концепции то, что функциональная гипертрофия мышц рассматривается в них в качестве следствия интенсификации синтеза мРНК структурных белков в ядрах мышечных клеток.
Существенный и принципиальный недостаток всех подобного рода концепций заключён в том, что при описанном подходе либо остаётся в тени, либо начисто выпадает из поля зрения исследователей наиважнейший фактор, определяющий объём синтезируемого в мышечной ткани белка, а именно: число молекул ДНК, на которых и происходит транскрипция мРНК.
Меерсон отмечает, что содержание ДНК в мышце является важным параметром, влияющим на синтез белка, но рассматривает данный параметр, в основном, как генетическую детерминанту, тесно связанную с функциональным предназначением той или иной мышечной ткани. Так, Меерсон отмечает, что для скелетных мышц, для левого и для правого желудочков сердечной мышцы масса мышечной ткани, приходящаяся на одну молекулу ДНК, различна (Ф.З.Меерсон 1993). Иными словами, чем интенсивнее функционирует мышечная ткань в процессе жизнедеятельности организма, тем выше в нейплотность ДНК.
Меерсон отмечает также и то, что в организме молодых животных функциональная адаптация сердца возможна через активацию деления кардиомиоцитов и их гиперплазию, однако осознание Меерсоном возможности такого пути адаптации сердечной мышцы к физической нагрузке не меняет его представлений о принципиальной схеме регуляции белкового синтеза в мышечной ткани.
А.А.Виру и Н.Н.Яковлев упоминают о включении меченых атомов в ДНК мышечных клеток после тренировки (А.А.Виру, Н.Н.Яковлев 1988), — что является свидетельством новообразования молекул ДНК. Однако при рассмотрении биохимических путей воздействия тренировочной нагрузки на мышцы данные исследователи основное своё внимание также уделяют интенсификации транскрипции РНК структурных белков под воздействием продуктов энергетического обмена.
Увеличение количества ДНК в скелетных мышцах как возможный фактор гипертрофии мышц Н.Н.Селуянов не рассматривает совсем. Объём белка, синтезируемого мышечной клеткой, в разработанной Селуяновым модели воздействия тренировки на организм человека является функцией времени активации транскрипции мРНК сократительных белков под воздействием повышенной в ходе активности мышц концентрации креатинаи Н+ (В.Н.Селуянов 1996).
Возможность увеличения содержания ДНК в скелетных мышцах в качестве фактора гипертрофии скелетных мышц остаётся практически без рассмотрения и в современных учебных пособиях (Н.И.Волков и др. 2000), (А.Дж.Мак-Комас 2001).
Увеличение числа ядер в мышечном волокне как фактор гипертрофии скелетных мышц
Мышечные волокна являются многоядерными клетками, образующимися в период развития эмбриона путём слияния эмбриональных миобластов в длинные продолговатые трубчатые структуры — миотубы, которые в дальнейшем, после контакта с прорастающими аксонами мотонейронов и синтеза в миотубах миофибрилл, преобразуются в мышечные волокна (Р.К.Данилов 1994), (Э.Г.Улумбеков, Ю.А.Челышев 1998), (А.Дж.Мак-Комас 2001),(Е.А.Шубникова и др. 2001). Число ядер в мышечном волокне определяется числом образовавших его миобластов и, как показывает ряд рассмотренных ниже исследований, число ядер в уже сформированных мышечных волокнах не является неизменным.
Хорошо известно, что мышцы животных и человека в процессе роста организма кардинально увеличивают свои размеры, массу и силу. Чтобы достигнуть размера, характерного для мышц взрослого человека, брюшко мышцы ребенка должно увеличиться примерно в 20 раз (А.Дж.Мак-Комас 2001). Ещё в 60-е годы прошлого века было установлено, что по мере роста организма животных в их мышечных волокнах кардинально увеличивается число ядер (M.Enesco, D.Puddy 1964), (F.P.Moss 1968). Было обнаружено, что для людей в возрасте от одного до семидесяти одного года объём мышечного волокна хорошо коррелирует с числом ядер в мышечном волокне, и объём мышечного волокна, приходящийся на одно ядро, фактически является постоянной величиной во всём исследованном возрастном диапазоне (D.Vassilopoulos et al. 1977).
Поначалу причина увеличения числа ядер в мышечных волокнах оставалась не вполне ясной, так как было известно, что ядра миобластов после слияния в мышечные волокна утрачивают способность к делению. В то же время было известно, что не все ядра мышечных волокон обладают одинаковыми свойствами; в частности, небольшая часть ядер (3-10%)отличается от основной их массы — ядра из этой небольшой части расположены в оболочке волокна между плазмолеммой и базальной мембраной, то есть отделены от саркоплазмы собственной оболочкой и представляют собой, по сути, отдельные клетки (A.Mauro 1961).Данные клетки получили название клеток-сателлитов или миосателлитоцитов. Впоследствии было обнаружено, что именно деление миосателлитоцитов и последующее их слияние с основным мышечным волокном является причиной увеличения числа ядер в мышечном волокне по мере роста организма (F.P.Moss, C.P.Leblond 1970).
Увеличение числа ядер в мышечных волокнах происходит во взрослом, уже сформированном организме под воздействием тренировки. Обнаружено, что гипертрофия мышц крыс, вызванная принудительным плаванием либо перегрузкой из-за отсечения мышц-синергистов, не сопровождается изменением плотности ядер в мышечных волокнах(D.Seiden 1976), что является свидетельством увеличения числа ядер пропорционально увеличению объёма мышечных волокон. Зафиксировано, что после тренировки плаванием дважды в неделю в течение тридцати пяти дней число клеточных ядер в extensor digitorum longus крыс возросло на 30% (N.T.James, M.Cabric 1981). Затем эти же исследователи обнаружили увеличение числа ядер в vastus lateralis собак, тренированных в беге (M.Cabric,N.T.James 1983). Перегрузка мышц задних конечностей кошек, вызванная отсечением gastrocnemius и soleus, сопровождается значительной гипертрофией plantaris и в течение трёх месяцев приводит к почти четырёхкратному увеличению числа ядер в быстрых волокнах и двукратному увеличению числа ядер в медленных волокнах этой мышцы (D.L.Allen et al. 1995).Отмечено увеличение числа ядер и в мышцах людей после электрически стимулируемого сокращения мышц (M.Cabric et al. 1987), аэробной (велотренажёр) и анаэробной (подъём ног с отягощением) тренировки (P.J.Pacy et al. 1987), тренировок со штангой (F.Kadi et al. 1999 a),(F.Kadi et al. 1999 b).
Источником новых ядер, появляющихся в мышечных волокнах под воздействием тренировки, равно как и в результате возрастной гипертрофии мышц, являются клетки-сателлиты. Так, было замечено, что длительное интенсивное движение по беговой дорожке с наклоном вниз (с преобладанием работы мышц в уступающем режиме), вызывает у крыс повреждение части мышечных волокон и активирует пролиферацию (то есть массированное деление и последующее дифференцирование клеток в сторону специализации на выполнении определённой функции) клеток-сателлитов с пиком активности данных клетокчерез 24-76 часов после нагрузки. При этом уровень активации клеток-сателлитов был выше, чем того требовалось бы для восстановления повреждённых волокон, то есть клетки-сателлиты были активированы не только в повреждённых волокнах, но и в тех волокнах, у которых не наблюдалось внешних признаков повреждения (K.C.Darr, E.Schultz 1987).Двукратное увеличение активности деления клеток-сателлитов зафиксировано в мышцах крыс после десяти недель беговых тренировок (K.M.McCormick, D.P.Thomas 1992). Отсечение мышц-синергистов (plantaris и gastrocnemius) у крыс вызывает перегрузку soleus, что активизирует деление клеток-сателлитов в данной мышце в первую неделю после начала перегрузки и впоследствии приводит к значительной гипертрофии soleus (M.H.Snow 1990).Процессы активации клеток-сателлитов и слияния их с мышечными волокнами были отмечены в мышцах людей при регулярных тренировках на велотренажёре (H.J.Appell etal. 1988). Обнаружено, что тренировка с отягощением приводит к увеличению в мышцах человека пропорции клеток-сателлитов и увеличивает процент морфологически активныхклеток-сателлитов (Roth SM et al. 2001).
Влияние интенсивности синтеза мРНК в ядре клетки на размер мышечного волокна
Как уже упоминалось выше, в ряде исследований было отмечено, что увеличение числа ядер в мышечных волокнах при их гипертрофии происходит таким образом, что объём волокна, приходящийся на одно ядро, остаётся практически неизменнойвеличиной (D.Seiden 1976), (D.Vassilopoulos et al. 1977). Было выдвинуто предположение, что отношение объёма мышечного волокна к числу ядер в нём, то есть объём мышечной клетки, контролируемый одним ядром (так называемая ДНК-единица (DNA-unit)), является величиной постоянной, и в организме заложены механизмы поддержания еёпостоянства (D.B.Cheek 1985). Впоследствии данная точка зрения неоднократно подтверждалась. Так, было показано, что мышцы крыс, подвергшиеся функциональной перегрузке в результате удаления мышц-синергистов, демонстрируют значительно большую гипертрофию при регулярном инъекционном введении гормона роста в сравнении с мышцами крыс, не получавшими инъекции гормона. Однако отношение объёма волокна к числу ядер в нём оказалось одинаковым не только у крыс, получавших и не получавших инъекции гормона, но и у тех крыс, мышцы которых не подвергались функциональной перегрузке и не увеличивались (G.E.McCall et al. 1998). Было обнаружено, что увеличенный относительно контрольной группы (составленной из людей, не занимавшихся поднятием тяжестей) объём мышечных волокон в трапециевидных мышцах высокотренированных пауэрлифтёров хорошо коррелирует с увеличенным числом ядер в данных мышцах — то естьразмер ДНК-единицы в мышцах спортсменов не превышает размера ДНК-единицы в мышцах представителей контрольной группы (F.Kadi et al. 1999 а). Сравнение мышц пауэрлифтёров, которые, по их собственному признанию, в течение нескольких последних лет принимали анаболические стероиды, с мышцами атлетов, воздерживавшихся от применения этих препаратов, показало, что между данными группами спортсменов нет существенного различия в размере ДНК-единицы (F.Kadi et al. 1999 b).
Однако из того факта, что гипертрофия мышечного волокна сопровождается, как правило, пропорциональным увеличением числа ядер в нём, никак нельзя делать вывод, что размер мышечного волокна во всех случаях определяется только числом ядер. Ограниченное увеличение размера ДНК-единицы происходит на ранних этапах развития организма. Обнаружено, что в организме молодых растущих крыс мышцы, в которых деление миосателлитоцитов блокировано воздействием радиации, всё же немного увеличивают свой размер и массу, хотя и значительно отстают в росте от необлучённых мышц, в которых деление миосателлитоцитов происходит в обычном порядке (P.E.Mozdziak et al. 1997). В этих же экспериментах было показано, что в мышцах, подвергшихся облучению, и в необлучённых мышцах размер ДНК-единицы возрастает в равной степени, то есть увеличениеразмера ДНК-единицы на ранних этапах развития организма является физиологически запрограммированным. Связан такой рост объёма волокна, обслуживаемого одним ядром, по-видимому, с тем, что размер ДНК-единицы мышечного волокна в молодом организме меньшеразмера ДНК-единицы, характерного для мышц зрелого организма. Возможно, увеличениеразмера ДНК-единицы на ранних этапах развития организма связано с возрастающей после рождения двигательной активностью мышц — на это указывает тот факт, что снятие нагрузки с растущих мышц прерывает увеличение размера ДНК-единицы (P.E.Mozdziak et al. 2000).Вместе с тем возможности увеличения размера ДНК-единицы, по-видимому, ограничены, поскольку в облучённых мышцах дополнительного увеличения размера ДНК-единицы,компенсирующего отставание мышц в развитии из-за меньшего числа ядер, непроисходит (P.E.Mozdziak et al. 1997).
Впрочем, снижение размера ДНК-единицы возможно в стареющем организме. В противоречие исследованиям, в которых постоянство размера ДНК-единицы было отмечено в мышцах людей в возрасте от одного до семидесяти одного года (D.Vassilopoulos et al. 1977),при аналогичных исследованиях мышц людей в возрастном диапазоне от семнадцати до восьмидесяти двух лет было обнаружено снижение размера ДНК-единицы в мышцах людей старше шестидесяти лет (P.Manta et al. 1987), то есть в мышцах пожилых людей наблюдалось снижение среднего размера волокон при сохраняющемся числе ядер. Возможно, такоеуменьшение ДНК-единицы связано со снижением с возрастом двигательной активности людей.
При атрофии мышц, вызванной значительным снижением двигательной активности, также отмечается снижение размера ДНК-единицы. Например, после денервации мышц кролика наблюдалась атрофия мышц, сопровождавшаяся снижением размера ДНК-единицы(J.A.Gustafsson et al. 1984). При снятии нагрузки с мышц задней конечности крыс в течение двадцати восьми дней число ядер в мышцах крыс не уменьшилось, в то время как размер волокон существенно снизился (до 70% от уровня контроля в быстрых и до 45% от уровня контроля в медленных). Следовательно, размер ДНК-единицы в атрофированных мышцах заметно снизился — в особенности, в медленных волокнах (C.E.Kasper, L.Xun 1996).Соблюдение группой добровольцев длительного (до четырёх месяцев) постельного режима привело к существенному (на 35% от первоначального уровня) снижению поперечного сечения мышечных волокон в камбаловидной мышце (95% волокон камбаловидной мышцы — медленные), при этом число ядер в волокнах осталось неизменным, то есть бездействие мышц привело к существенному снижению размера ДНК-единицы медленныхволокон (Y.Ohira et al. 1999). В указанных экспериментах атрофия мышц не сопровождалась снижением числа клеточных ядер в мышечных волокнах, но в ряде случаев при атрофии мышц наблюдалось как уменьшение размера ДНК-единицы, так и уменьшение числа ядер. Например, в мышцах задней конечности кошек после шести месяцев бездействия (по причине спиноизоляции, то есть изоляции спинного мозга от воздействия головного) было отмечено как снижение размера ДНК-единицы, так и уменьшение числа ядер (D.L.Allen et al. 1995). В мышцах крыс после двухнедельного пребывания в невесомости зафиксировано как уменьшение числа ядер в медленных мышечных волокнах, так и уменьшениеразмера ДНК-единицы медленного волокна, при этом число ядер и размер ДНК-единицы в быстрых волокнах остались неизменными (D.L.Allen et al. 1996). Признаки апоптоза (то есть самоуничтожения ДНК) ядер обнаружены в мышцах крыс как после двухнедельного космического полёта (D.L.Allen et al. 1997), так и после нескольких дней фиксации мышц кролика в сокращённом состоянии (H.K.Smith et al. 2000).
Итак, уменьшение интенсивности синтеза белка и снижение размера ДНК-единицыявляется основным фактором атрофии мышечных волокон при их длительном бездействии, однако определённый вклад в атрофию скелетных мышц могут вносить также приостановка деления клеток-сателлитов и гибель уже существующих ядер. Известно, что атрофия мышц, вызванная гипокинезией, обратима (X.J.Musacchia et al. 1980), (Y.Ohira et al. 1999). При восстановлении после атрофии происходит восстановление и даже некоторое увеличениеразмера ДНК-единицы (Y.Ohira et al. 1999).
Умеренное повышение размера ДНК-единицы может происходить не только в постнатальный (послеродовой) период или при восстановлении мышц после атрофии, но и при функциональной гипертрофии мышц. Так, в уже упомянутых экспериментах (D.L.Allen et al. 1995) гипертрофия медленных волокон в перегруженных мышцах кошек сопровождалась увеличением размера ДНК-единицы примерно на 28%. Однако увеличение размера ДНК-единицы не внесло существенного вклада в гипертрофию мышц, поскольку наблюдавшееся приращение размера ДНК единицы могло увеличить площадь поперечного сечения медленных волокон всего на 28%, в то время как в целом площадь поперечного сечения увеличилась примерно в 2,5 раза (главным образом за счёт почти двукратного увеличения числа ядер).
Те обстоятельства, что размер ДНК-единицы зависит от уровня двигательной активности мышц, но возможности приращения размера ДНК-единицы при увеличении нагрузки на мышцы в то же время весьма ограничены, свидетельствуют, по-видимому, о том, что существует предельный объём мышечного волокна, который способно обслуживать одно ядро.
Есть предположение, что ограниченность размера ДНК-единицы может быть связана с расстояниями от ядра, на которые возможна эффективная доставка мРНК либо синтезированных белков (R.R.Roy et al. 1999).
Так, in vitro было показано, что в многоядерных клетках мРНК сосредоточена в ограниченном объёме вокруг экспрессирующего её ядра (E.Ralston, Z.W.Hall 1992), вокруг ядра же локализованы и на определённом удалении от него не встречаются белки, синтезированные на основе мРНК, экспрессируемой ядром (G.K.Pavlath et al. 1989).
Вместе с тем лимитирующим размер ДНК-единицы фактором может служить достижение предела возможностей одного ядра по синтезу определённых видов РНК. В пользу последнего свидетельствует тот факт, что медленные волокна при том же или даже меньшем размере, что и быстрые, имеют большее число ядер — соответственно, плотность ядер в медленных волокнах выше, а размер ДНК-единицы меньше, чем в быстрыхволокнах (I.G.Burleigh 1977), (J.A.Gustafsson et al. 1984), (B.S.Tseng et al. 1994),(C.E.Kasper, L.Xun 1996), (R.Roy et al. 1999). Возможно, большая плотность ядер в медленных волокнах обусловлена тем, что обмен белкового вещества в медленных волокнах примерно в два раза выше, чем в быстрых (F.J.Kelly et al. 1984), и предел возможностей ядра по синтезу некоторых видов РНК в медленных волокнах легко достижим, а потому ядра медленных волокон способны обслуживать меньший объём саркоплазмы, чем ядра быстрых. Статистический анализ распределения ядер в мышечных волокнах различного диаметра показал, что в медленных волокнах по мере увеличения их диаметра имеется тенденция к сохранению объёма волокна, обслуживаемого одним ядром, а в быстрых волокнах имеется тенденция к сохранению площади поверхности волокна (ядра в зрелых волокнах расположены непосредственно под оболочкой), приходящейся на одно ядро (J.C.Bruusgaard etal. 2003). Последнее наблюдение свидетельствует в пользу того, что в медленных волокнах ограничителем размера ДНК-единицы в большей степени являются возможности ядра всинтезе РНК, а в быстрых волокнах ограничителем выступают транспортные расстояния.
При решении вопроса о необходимости пересмотра концепции, увязывающей гипертрофию скелетных мышц с активацией транскрипции мРНК структурных белков, следует в первую очередь узнать ответ вот на какой вопрос: является ли увеличение числа ядер в мышечных волокнах первичной причиной гипертрофии волокон или же это следствие всё тех же процессов интенсификации синтеза мРНК?
На первом этапе адаптации мышц к нагрузке может происходить интенсификациятранскрипции мРНК и усиление синтеза белка и, как следствие, наблюдаться ростразмера ДНК-единицы. А уже вслед за этим в качестве адаптации к увеличенномуразмеру ДНК-единицы может происходить активация клеток-сателлитов и увеличение числа ядер в волокне, то есть восстановление оптимального размера ДНК-единицы. Против последнего предположения свидетельствует ряд следующих приведённых ниже фактов.
Было обнаружено, что активация и быстрое увеличение клеток-сателлитов в мышечных волокнах является первичной реакцией на различные виды перегрузки мышц животных, как то: растягивание мышц перепелов путём прикрепления груза к крыльям (M.H.Snow 1990) или перегрузка мышц крыс, вызванная удалением мышц-синергистов (P.K.Winchester et al. 1991).Активация миосателлитоцитов наблюдается в первые дни после начала перегрузки мышц, а вот существенная гипертрофия мышц наблюдается уже впоследствии.
В ряде исследований было отмечено, что гипертрофия мышц не только не является следствием увеличения размера ДНК-единицы, но, наоборот, размер ДНК-единицы при гипертрофии мышц может даже уменьшиться. Так, в быстрых волокнах кошек, подвергнутых функциональной перегрузке из-за удаления мышц-синергистов, наблюдается снижениеразмера ДНК-единицы на фоне почти четырёхкратного увеличения числа ядер (D.L.Allen etal. 1995).
Инъекции тестостерона в течение двадцати недель в дозировке 300-600 мг в неделю привели к гипертрофии vastus lateralis человека, при этом размер ДНК-единицы в мышечных волокнах данной мышцы не только не был увеличен, но, наоборот,уменьшился (I.Sinha-Hikim et al. 2003), то есть гормонально индуцируемая гипертрофия мышечных волокон произошла исключительно за счёт увеличения числа ядер.
Отсечение определённых мышц у животных вызывает компенсаторную гипертрофиюмышц-синергистов — например, удаление у крыс tibialis anterior вызывает гипертрофию extensor digitorum longus, однако если до удаления tibialis anterior в digitorum longus блокировать возможность деления клеток-сателлитов, обработав мышцы крыс радиацией, то компенсаторной гипертрофии extensor digitorum longus не наблюдается (J.D.Rosenblatt etal. 1994). Это свидетельствует о том, что сколько-нибудь существенная гипертрофия мышечных волокон только за счёт интенсификации синтеза мРНК без увеличения числа ядер в волокне просто невозможна.
Итак, можно считать достоверно установленным, что активация клеток-сателлитов,приводящая к увеличению числа ядер в мышечном волокне, является именно причиной гипертрофии мышечных волокон, но никак не её следствием.
Гиперплазия мышечных волокон как возможный механизм адаптации скелетных мышц
Хорошо известно, что при повреждении мышц клетки-сателлиты, высвободившиеся из оболочки отмирающих по тем или иным причинам волокон, сливаются в новые волокна, за счёт чего и происходит регенерация повреждённой ткани (E.V.Dmitrieva 1975),(M.H.Snow 1977), (W.E.Pullman, G.C.Yeoh 1978), (Р.К.Данилов 1994), (А.В.Володина 1995),(Э.Г.Улумбеков, Ю.А.Челышев 1998), (Е.А.Шубникова и др. 2001). Как правило, при сохранении структуры мышцы новые мышечные волокна формируются в области, ограниченной базальной мембраной старого волокна, то есть замещают собой повреждённые волокна. Такие регенерационные процессы после тренировки происходят в мышцах всех животных. Об этом свидетельствуют исследования, в которых при различных видах функциональной перегрузки мышц животных были зафиксированы повреждения мышечных волокон и последующие регенерационные процессы, связанные с активациейклеток-сателлитов (K.C.Darr, E.Schultz 1987), (M.H.Snow 1990), (K.M.McCormick,D.P.Thomas 1992), (P.K.Winchester, W.J.Gonyea 1992), (T.Tamaki et al. 1997), а также исследования, позволившие после различных видов функциональной перегрузки мышц как лабораторных животных, так и человека обнаружить в этих мышцах тонкие волокна с формирующимся сократительным аппаратом (A.Salleo et al. 1980), (C.J.Giddings,W.J.Gonyea 1992), (P.K.Winchester, W.J.Gonyea 1992), (K.M.McCormick, D.P.Thomas 1992),(T.Tamaki et al. 1997), (V.F.Kondalenko et al. 1981), (H.J.Appell et al. 1988), (F.Kadi et al 1999 а).
Но можно ли считать молодые мышечные волокна свидетельством именно гиперплазии, то есть увеличения числа волокон в мышце? Не является ли появление данных волокон результатом исключительно заместительной регенерации? A.Salleo с соавторами зафиксировали в мышцах крыс, испытывавших перегрузку после отсечениямышц-синергистов, отделение клеток-сателлитов от оболочки мышечного волокна, их последующее интенсивное деление и затем слияние в продолговатые структуры, которые затем становились новыми мышечными волокнами (A.Salleo et al. 1980). Образование новых волокон в межклеточном пространстве было зафиксировано также в перегруженных мышцахцыплят (J.M.Kennedy et al. 1988) и крыс (T.Tamaki et al. 1997). Поскольку молодые мышечные волокна могут образовываться как в дополнение к существующим волокнам, так и взамен волокон, подвергшихся некрозу, наличие таких волокон в мышцах животных или человека после тренировки нельзя считать достаточным свидетельством гиперплазии волокон. С уверенностью констатировать факт гиперплазии волокон можно лишь в тех случаях, когда удаётся зафиксировать собственно увеличение числа волокон в мышце.
Увеличение числа мышечных волокон в мышцах крыс наблюдается в первые недели после рождения (J.Rayne, G.N.Crawford 1975), (T.Tamaki 2002). Однако многие исследователи склоняются к мнению, что гипертрофия мышц животных в зрелом возрасте не связана с гиперплазией и полностью объясняется гипертрофией уже существующих волокон. Так, в ряде экспериментов увеличение числа волокон при гипертрофии мышц крыс, вызванной удалением мышц-синергистов, зафиксировано не было (P.D.Gollnick et al. 1981), (B.F.Timson etal. 1985), (M.H.Snow, B.S.Chortkoff 1987). Длительное растягивание мышц нелетающих птиц, осуществлённое посредством прикрепления к крыльям груза, сопровождающееся гипертрофией мышц, также не привело к увеличению числа волокон (P.D.Gollnick et al. 1983),(J.Antonio, W.J.Gonyea 1993 a).
В то же время, несмотря на отрицательный результат ряда упомянутых выше экспериментов, удалось зафиксировать гиперплазию волокон в мышцах птиц, подвергнутых хроническому растягиванию. В экспериментах S.E.Alway с соавторами к одному крылу перепелов прикреплялся груз, равный 10% от веса тела птицы, и после месяца перегрузки число волокон в растягивавшейся мышце на 51,8% превысило число волокон в ненагруженной мышце, использованной как контрольный объект (S.E.Alway et al. 1989 b).Аналогичные эксперименты, но с прогрессивным увеличением массы груза, привели к ещё большему увеличению числа волокон — на 82% после двадцати восьми днейперегрузки (J.Antonio, W.J.Gonyea 1993 b).
Обнаружены и свидетельства гиперплазии мышечных волокон в тренированных мышцах млекопитающих. W.Gonyea и его соавторы одними из первых зафиксировали гиперплазию в мышцах млекопитающих (W.J.Gonyea et al. 1977). В ходе данного эксперимента кошки были приучены поднимать одной из лап груз, а стимулом к поднятию груза являлось пищевое вознаграждение. После сорока шести недель занятий мышцы тренированных и нетренированных лап кошек были подвергнуты гистохимическому анализу. Общее количество мышечных волокон в тренированных лапах было на 19,3% больше, чем в нетренированных. Результаты этих исследований впоследствии были подтверждены аналогичными экспериментами (W.J.Gonyea et al. 1986). Увеличение на 14% числа мышечных волокон зафиксировано и в мышцах задних конечностей крыс, регулярно (4-5 раз в неделю) втечение 12 недель выполнявших с помощью специально сконструированного устройства упражнение, аналогичное приседаниям с весом (T.Tamaki et al. 1992). Однако, несмотря на успехи в экспериментах с животными, прямых свидетельств увеличения числа мышечных волокон в мышцах человека до сих пор обнаружено не было.
По мнению ряда исследователей, гипертрофия мышц человека в результате тренировки полностью объяснима гипертрофией уже существующих волокон, новые же волокна в результате тренировки не образуются (Б.С.Шекман 1990), (G.E.McCall et al. 1996). Вместе стем, G.E.McCall с соавторами не рискнули сделать однозначное заключение о том, что гиперплазия у человека принципиально невозможна, поскольку у ряда индивидов увеличение поперечного сечения мускула, вызванное тренировкой, не коррелировало с увеличением среднего поперечного сечения волокон (G.E.McCall et al. 1996).
То, что прямые свидетельства гиперплазии волокон в мышцах человека до сих пор не обнаружены, возможно, связано с ограниченностью применимых к человеку методов функциональной перегрузки и методов оценки числа волокон в мышцах: ведь такие методы функциональной перегрузки, как длительное многодневное растягивание мышц (в наибольшей степени вызывающее гиперплазию волокон у животных), к человеку применить довольно затруднительно. Существенная гипертрофия мышц человека (как в случае экстремального развития мышц профессиональных бодибилдеров, тяжелоатлетов и пауэрлифтёров) происходит в течение многих лет тренировок; сравнение же числа волокон в мышцах спортсменов до начала тренировок и после многолетнего периода тренировок никогда не проводилось.
Если же проявления гиперплазии волокон у человека имеют ограниченный характер, и она, гиперплазия, вносит существенный вклад в гипертрофию мышц только в накопительном режиме в рамках многолетнего тренировочного периода, то обнаружение проявлений гиперплазии после относительно короткого периода тренировок, ограниченного временными рамками эксперимента, окажется весьма проблематичным — в особенности с учётом ограниченности методов подсчёта волокон, применимых к человеку. Эксперименты, в которых гиперплазия мышц была обнаружена у животных, как правило, сопровождались умерщвлением подопытных животных и подсчётом полного числа волокон в мышцах. Так, в уже упомянутых экспериментах (W.J.Gonyea et al. 1977), (W.J.Gonyea et al. 1986) гиперплазия волокон была обнаружена благодаря сравнению полного числа волокон в мышцах, извлечённых из тренированной и нетренированной конечностей одного и того же животного. Понятно, что такие прямые методы обнаружения гиперплазии к человеку неприменимы.
Тем не менее, есть эксперименты, в которых проявления гиперплазии у человека исследовались близким методом. Подсчёт полного числа волокон в anterior tibialis левой и правой ног человека проводился в мышцах, изъятых из трупов предварительно здоровых молодых людей (M.Sjostrom et al. 1991). Мышцы доминирующей опорной конечности (левой для правшей) обладали несколько большим размером и большим числом волокон — при том, что среднее поперечное сечение волокон в мышцах обеих конечностей было одинаковым. Эти данные наиболее убедительно свидетельствуют в пользу того, что функциональная гипертрофия мышц человека, возможно, всё-таки связана с гиперплазией волокон (хотя тут нельзя исключать и изначальные генетические различия в мышцах доминирующей и не доминирующей конечностей).
В большинстве же случаев об изменении числа волокон у человека под воздействием тренировки приходится судить только на основе косвенных оценок, сделанных путём сопоставления размера мышцы и среднего поперечного сечения волокон в биопсиях, взятых из данной мышцы. Но результаты даже таких исследований весьма противоречивы.
Например, при сравнении мышц элитных бодибилдеров мужского и женского пола была обнаружена корреляция между размером мышцы и числом волокон в ней (S.E.Alway etal. 1989 a). Мышцы мужчин имели в среднем в два раза больший размер, чем мышцы женщин. Частично больший размер мышц мужчин объясняется большим поперечным сечением мышечных волокон в их мышцах, но в то же время мышцы мужчин имели и большее число волокон, чем мышцы женщин. Последнее может являться как следствием гиперплазии волокон, так и следствием генетических различий между полами. Сравнение проб, взятых из трицепса двух пауэрлифтёров международного уровня и пяти элитных культуристов, с пробами, взятыми из мышц представителей контрольной группы, практиковавших тренировки с отягощением только в течение шести месяцев, показало, что несмотря на большие различия в силе и обхвате рук между представителями элитной и контрольной групп не имелось никакого существенного различия в поперечном сечении мышечныхволокон (J.D.MacDougall et al. 1982). Эти данные подтверждает и исследование L.Larssonи P.A.Tesch, в котором обнаружилось, что поперечное сечение волокон в биопсиях, взятых из мышц бедра и бицепса четырёх бодибилдеров, не отличается от поперечного сечения волокон обычных физически активных людей (L.Larsson, P.A.Tesch 1986). Результаты данных исследований указывают на то, что больший объём мышц бодибилдеров связан с большим числом волокон в их мышцах. Объяснение этому феномену можно найти либо в генетически заложенном различие в числе мышечных волокон у элитных бодибилдеров и пауэрлифтёров, либо в гиперплазии волокон в результате тренировок. Генетическое объяснение кажется в данном случае наименее убедительным, поскольку из него должно следовать, что изначально спортсмены имели очень тонкие волокна и многолетние тренировки смогли привести лишь к тому, что их волокна достигли размера, характерного для обычного среднетренированного человека.
Исследования J.D.MacDougall с соавторами и L.Larsson с P.A.Tesch можно было бы считать надёжным свидетельством гиперплазии мышечных волокон у человека в результате тренировки, если бы не аналогичное, но более репрезентативноеисследование J.D.MacDougall с соавторами (J.D.MacDougall et al. 1984). В данном исследовании было выявлено количество волокон в мышцах бицепса пяти элитных культуристов, семи культуристов среднего уровня и тринадцати не специализировавшихся в бодибилдинге мужчин. Несмотря на то, что количество волокон в мышцах спортсменов сильно варьировало от индивида к индивиду и спортсмены с большим развитием мышц имели большее же число волокон в мышцах, авторы исследования пришли к выводу, что такие различия в числе волокон являются следствием генетической предрасположенности, а вовсе не гиперплазии, поскольку разброс числа волокон наблюдался внутри каждой группы, но среднее число волокон в мышцах представителей всех трёх групп кардинально не различалось.
Итак, совокупность экспериментальных фактов свидетельствует о том, что гиперплазия мышечных волокон у животных возможна и связана она, по-видимому, с повреждением мышечных волокон в результате функциональной перегрузки, пролиферацией клеток-сателлитов и последующими регенерационными процессами. Тем не менее, возможность гиперплазии мышц человека по-прежнему остаётся под вопросом. Возможно, регенерационный потенциал мышц человека не столь велик, чтобы микротравмирование волокон при тренировке могло вызвать их гиперплазию, но инъекционное применение таких стимуляторов клеточного деления, как гормон роста и анаболические стероиды, может значительно повысить регенерационные возможности мышц человека. Известно, что гормон роста через своего посредника — инсулиноподобный фактор роста (ИФР-1) — стимулирует пролиферацию слабо дифференцированных клеток — таких, как хондроциты, фибробластыи др. (М.И.Балаболкин 1998). Установлено, что ИФР-1 стимулирует пролиферацию и дальнейшее дифференцирование также и миосателлитоцитов (R.E.Allen, L.L.Rankin 1990),(G.E.McCall et al. 1998). Инъекции анаболических стероидов также стимулируют пролиферацию клеток-сателлитов (I.Sinha-Hikim et al. 2003). Не секрет, что профессиональные бодибилдеры нередко прибегают в своей практике к инъекциям гормона роста и анаболических стероидов, соответственно, деление и дифференцирование клеток-сателлитовдолжно происходить в их мышцах гораздо интенсивнее, чем у спортсменов, не применяющих данные препараты. Вопрос о том, может ли такая фармакологическая интенсификация активности миосателлитоцитов способствовать гиперплазии волокон у человека, требует дальнейшего изучения.
На данном же уровне имеющихся знаний о внутримышечных процессах, активируемых тренировкой, при построении новой и более адекватной концепции долговременной адаптации мышц к нагрузке необходимо ограничиться более общим заключением, которое можно считать достаточно обоснованным в ходе настоящего исследования: сколько-нибудьсущественная гипертрофия скелетных мышц человека под воздействием регулярной тренировки является следствием пролиферации клеток-сателлитов и увеличениясодержания ДНК в мышцах. Происходит ли увеличение содержания ДНК в мышцах только за счёт увеличения числа ядер в ранее существовавших волокнах, либо содержание ДНК в мышце увеличивается ещё и за счёт ядер вновь образованных мышечных волокон — всё это до окончательного решения вопроса о возможности гиперплазии мышечных волокон у человека можно специально не обговаривать.
Наброски новой концепции
При развитии функциональной гипертрофии мышц доминирует следующая последовательность событий:
Увеличение нагрузки на мышцы —> активация пролиферации миосателлитоцитов —>увеличение числа ядер в мышце —> синтез РНК на новых ядрах —> синтез новых сократительных структур —> гипертрофия мышц
Снижение двигательной активности мышц, в свою очередь, активизирует вот какую последовательность событий, приводящих к атрофии мышц:
Снижение двигательной активности мышц —> снижение интенсивности транскрипции мРНК структурных белков и снижение пролиферативной активности миосателлитоцитов —> уменьшение размера ДНК-единицы и снижение числа ядер по мере их апоптоза —> атрофия мышц
Ввиду ограниченности размера ДНК-единицы изменение интенсивноститранскрипции мРНК структурных белков играет важную роль в процессах атрофии мышц, но не в процессах их гипертрофии. Вместе с тем следует отметить, что от интенсивноститранскрипции мРНК структурных белков зависит не только размер ДНК-единицы.Посредством управления интенсивностью экспрессии генов осуществляется регуляция спектра синтезируемых белков, что оказывает кардинальное влияние на функциональные свойства мышц.
Сравнение состава мышц крыс после компенсаторной гипертрофии, вызванной отсечением мышц-синергистов, и после функциональной гипертрофии, вызванной регулярным принудительным плаванием, показало, что компенсаторная гипертрофия сопровождается увеличением плотности митохондрий, уменьшением плотности миофибрилл и неизменностью плотности саркоплазматического ретикулума. В свою очередь, функциональная гипертрофия сопровождается увеличением плотности саркоплазматического ретикулума, а плотность митохондрий и миофибрилл остаётся неизменной (D.Seiden 1976).
В результате тренировок в мышцах может возрастать концентрация одних ферментов, обеспечивающих воспроизводство энергии, при неизменности концентрации других ферментов — в результате чего мышцы изменяют свои окислительные или гликолитическиевозможности (N.Wang et al. 1993).
Под воздействием тренировки возможно изменение характерных свойств мышечных волокон вплоть до изменения типа волокон (F.Ingjer 1979), (R.S.Staron et al. 1990), (N.Wang etal. 1993).
Изменения структуры и свойств мышц под воздействием тренировки не исчерпываются приведёнными выше примерами, но рассмотрение этих изменений не является темой настоящего исследования. Данные примеры были приведены лишь для того, чтобы показать, что изменения, происходящие с мышечными волокнами в результате тренировки, могут быть связаны с изменением белкового состава волокон, то есть могут являться следствием изменения интенсивности транскрипции мРНК различных видов структурных белков. Соответственно, воздействие тренировки на генетический аппарат мышечной клетки не может сводиться к усилению общего синтеза белка через общий для всех структурных белковфактор-регулятор. Более того, интенсификация синтеза некоторых видов сократительных белков происходит отнюдь не только при возрастании двигательной активности мышц. Так, снижение нагрузки на мышцы крыс, вызванное пребыванием животных в невесомости, снижает в ряде медленных волокон синтез цепей миозина, характерных для медленных волокон, но увеличивает экспрессию некоторых форм быстрого миозина (D.L.Allen et al 1996).Обратным образом, функциональная перегрузка мышц кошек снижает экспрессию некоторых форм быстрого миозина в медленных волокнах (D.L.Allen et al 1995). Эти факты не укладываются в концепцию прямого активирующего воздействия факторов энергетического истощения на экспрессию мРНК сократительных белков. Экспрессия мРНК сократительных белков мышц если и зависит от метаболических факторов, то зависимость эта проявляется, по-видимому, более сложным образом.
Как было отмечено в начале данного текста, часть спортивных исследователей отводит роль регулятора транскрипции мРНК сократительных белков мышц креатину, однако роль креатина в регуляции синтеза сократительных белков нельзя считать однозначно установленной. Действительно, в ряде исследований (J.S.Ingwall et al. 1972), (J.S.Ingwall etal. 1974), (M.L.Zilber et al. 1976) было показано, что повышение концентрации креатина интенсифицирует синтез специфических мышечных белков (миозина и актина) в развивающихся мышечных клетках in vitro. Эти наблюдения были восприняты как важное свидетельство того, что индуктором транскрипции сократительных белков является именно креатин. Однако впоследствии в противовес упомянутым выше исследованиям влияние креатина на синтез миозина обнаружено не было (D.M.Fry, M.F.Morales 1980), (R.B.Young,R.M.Denome 1984). R.B.Young и R.M.Denome предположили, что уровень креатина может регулировать синтез миозина лишь на ранних этапах эмбрионального развития мышечных клеток, но не может являться регулятором синтеза сократительных белков в уже сформированных мышечных волокнах.
Таким образом, гипотеза о роли креатина в регуляции синтеза сократительных белков требует дальнейшей проверки. Тем не менее, исходя из общих соображений, следует признать, что концепция, согласно которой индуктором транскрипции мРНК структурных белков является креатин или какой-либо иной фактор, связанный с истощением энергетики мышц, кажется достаточно убедительной лишь в отношении регуляции синтеза мышечных ферментов — если предположить, что регуляция ферментного синтеза в сложных многоклеточных организмах осуществляется по тому же принципу, что и у прокариот. Такие метаболилы, как АДФ, АМФ, ортофосфат, креатин и др., накапливающиеся в активно сокращающихся мышечных волокнах, сами являются субстратами для реакций, восстанавливающих запас энергетических фосфатов в волокне. Соответственно, накопление в мышцах указанных метаболилов должно стимулировать транскрипцию мРНК ферментов, которые обеспечивают протекание энерговосстанавливающих реакций, использующих данные метаболилы в качестве субстратов. Регулярная работа до утомления мышц должна сопровождаться регулярной активацией синтеза ферментов и в конечном итоге приводить к их накоплению в мышцах. Обратным образом, снижение двигательной активности мышц должно снижать частоту активирования синтеза мРНК ферментов. Соответственно, содержание в мышцах ферментов по мере естественного катаболизма последних должно убывать. Предположение, что накопление в мышцах ферментов происходит вследствие субстратно-индуцируемого усиления синтеза данных ферментов, выдвинул ещёН.Н.Яковлев (Н.Н.Яковлев 1974). Ф.З.Меерсон в обоснование гипотезы о влиянии ацидоза мышц на индукцию мРНК структурных белков привёл аргументы, которые также касаются индукции синтеза белков, ответственных именно за энергообеспечение мышц. Меерсон отметил, что ацидоз мышц является ранним сигналом энергетической недостаточности, и потому с позиций эволюционной теории оправданно будет предположить, что этот же сигнал вполне может использоваться в качестве активатора генетического аппарата клетки. В конечном итоге сие должно приводит к росту структур, которые призваны устранять дефицит энергии — и организм тем самым становится в целом более резистентными к изменившимся условиям внешней среды (Ф.З.Меерсон 1993).
Такую аргументацию можно признать весьма убедительной, но вот расширение данного принципа на регулирование синтеза иных видов мышечных белков, в особенности сократительных (как это происходит в концепции того же Меерсона и многих иных исследователей), кажется уже не совсем оправданным именно с эволюционной точки зрения. Высокая концентрация в саркоплазме продуктов распада макроэнергетических фосфатов является сигналом о том, что возможности мышечного волокна в восстановленииуровня АТФ за счёт окислительных процессов и гликолиза недостаточны для данной интенсивности сокращения. В такой ситуации адаптация мышечного волокна должна быть направлена в сторону увеличения мощности восстанавливающих энергию реакций. Синтез же сократительных белков (основных потребителей энергии) может способствовать лишь увеличению скорости расхода АТФ в волокне и приводить к ещё большему падениюуровня АТФ при новых аналогичных нагрузках — поэтому адаптация в данном направлении не может сделать мышечные волокна более устойчивыми к изменившейся требованиям в отношении двигательной активности мышц.
Таким образом, стимулы к развитию энергетики мышц и стимулы к экстенсивному развитию сократительного аппарата мышц должны иметь и, похоже, имеют разную природу.
Как уже было отмечено выше, совершенствование энергетических возможностей мышц тесно связано с увеличением содержания в мышцах ферментов, то есть является следствием субстратно-индуцируемого активирования транскрипции мРНК данных видов белка. Вполне вероятно, что синтез мРНК иных видов белка, связанных с энергообеспечением мышц (например, миоглобина или митохондриальных белков) может происходить по схожей схеме. Но, как показано выше, размер ДНК-единицы ограничен и каждое клеточное ядро ответственно за поддержание функционирования строго определённого объёма мышечного волокна. Для кардинального увеличения объёма мышц и строительства в них новых сократительных структур нужны новые клеточные ядра в дополнение к уже существующим, то есть экстенсивное развитие мышц связано в первую очередь с активацией пролиферацииклеток-сателлитов. Вместе с тем очевидно, что поскольку белковый состав сократительных структур различен для различных типов волокон и зависит от режима функционирования мышц, сигналы какого-то иного рода, воздействующие на генетический аппарат мышечных клеток, должны дополнительно регулировать спектр экспрессируемых сократительных белков.
Приведённый в настоящем тексте анализ показал, что общепринятая схема взаимосвязи звеньев срочной и долговременной адаптации мышц к нагрузке (см. рис. 2)

Рисунок 2
в отношении скелетных мышц описывает лишь часть адаптационных процессов, а именно — адаптацию энергетической системы мышц. Эта схема оставляет без внимания ряд важных механизмов долговременной адаптации скелетных мышц к нагрузке, а потому требует значительного уточнения (см. рис. 3).

Рисунок 3 (ЭОС — энергообеспечивающие системы)
Следует отметить, что предлагаемая блок-схема механизмов адаптации мышц к нагрузке также не является исчерпывающей, поскольку не включает в себя достаточно важные механизмы гормональной адаптации организма к нагрузке — в ней учтены лишь основныелокальные (внутримышечные) адаптационные процессы, которые только и были предметом рассмотрения настоящего исследования.
Возникает вопрос: каковы последствия такого изменения принципиальной схемы адаптации для теории спортивной тренировки, то есть имеет ли для разработки тренировочных методик и планирования нагрузки значение то, за счёт каких именно процессов происходит адаптация мышц? Ответ на данный вопрос таков: да, судя по всему, изменение представлений о схеме адаптации мышц к нагрузке имеет немалое значение.
Дело в том, что интенсивная сократительная активность мышц блокирует синтез белка в мышцах и даже активизирует его катаболизм. Следовательно, рациональным следует считать такой режим тренировок, при котором новое тренировочное занятие сочетается по времени с отключением адаптивного синтеза белка после предыдущего тренировочного занятия или же со значительным снижением его интенсивности (А.А.Виру,Н.Н.Яковлев 1988). Если при реализации данного принципа исходить из того, что тренировочное воздействие сводится лишь к активированию транскрипции мРНКструктурных белков под воздействием единого фактора-регулятора, то максимальный эффект будет иметь место в результате применения крайне простой тренировочной схемы со следующими друг за другом через равные интервалы отдыха тренировочными занятиями, интенсивность которых возрастает по мере тренированности организма. Однако, к сожалению, из спортивной практики хорошо известна малая эффективность такого рода тренировочных методик, в особенности для хорошо тренированных спортсменов.
Из предложенной в настоящем тексте схемы развития долговременной адаптации скелетных мышц (см. рис. 3) видно, что адаптивное усиление синтеза белка связано не только с процессами активирования транскрипции мРНК структурных белков, но и с увеличением объёма синтезированного белка за счёт синтеза белка на мРНК, экспрессируемыхновообразованными ДНК. Причём посттренировочное активирование транскрипции мРНКиграет наиболее важную роль в регуляции синтеза белков, связанных с энергообеспечением мышц. Для повышения энергетических возможностей мышц тренировочные занятия, активирующие транскрипцию мРНК белков энергообеспечивающих систем, следует проводить в такой период, когда адаптивный синтез данных белков, вызванный предыдущим тренировочным занятием, близок к завершению или, во всяком случае, прошёл фазу наивысшей активности.
Адаптивное же усиление синтеза белка за счёт мРНК, экспрессируемых новообразованными ядрами, можно считать завершённым только тогда, когда завершено строительство новых сократительных структур на основе новообразованных ядер, то есть когда в мышцах после увеличения числа ядер восстановлен характерныйразмер ДНК-единицы. Строительство сократительных структур с нуля в отличие от синтеза ферментов — процесс весьма длительный, поэтому оптимальная частота тренировочных занятий, активирующих пролиферацию миосателлитоцитов, может кардинально отличаться от оптимальной частоты тренировок, обеспечивающей максимальный синтез белков энергообеспечивающих систем мышц.
В предлагаемой блок-схеме локальных механизмов долговременной адаптации скелетных мышц два блока отмечены знаком вопроса, а факторы-регуляторы не определены. Как уже отмечалось выше, факторами-регуляторами синтеза ферментов являются продукты энергетического метаболизма, а вот совокупность факторов, влияющих на спектр экспрессируемых сократительных белков, а также факторы, активирующие пролиферацию миосателлитоцитов, до настоящего времени в полной мере не установлены. Продвижение исследований в данных направлениях позволит в будущем разработать более специализированные методы тренировки, направленно стимулирующие различные адаптационные процессы в мышцах. В свою очередь, более чёткое разделение тренировочного воздействия позволит оптимизировать дозирование нагрузки в тренировочном микроцикле.
Литература:
1. Аракелян Е.Е., Збарский В.А., Шевченко Т.Н., Селуянов В.Н. "Формирование техники спринтерского бега посредством направленного развития силы отдельных мышечных групп у юных атлетов" Физическая культура: воспитание, образование, тренировка. 1997 г. № 3 2. Березов Т.Т., Коровкин Б.Ф. "Биологическая химия" Изд. "Медицина" Москва 1998 г. 704 стр. 3. Балаболкин М.И. "Эндокринология" Москва "Универсум паблишинг" 1998 г. 4. Виру А.А., Яковлев Н.Н. "Главы из спортивной физиологии" Изд. Тартуского государственного университета. Тарту 1988 г. 134 стр. 5. Волков Н.И., Нессен Э.Н., Осипенко А.А., Корсун С.Н. "Биохимия мышечной деятельности" Изд. "Олимпийская литература" Киев 2000 г. 503 стр. 6. Володина А.В. "Посттравматическая регенерация скелетных мышц" Диссертация доктора биологических наук. Москва 1995 г. 7. Данилов Р.К. "Очерки гистологии мышечных тканей" Уфа 1994 г. 49 стр. 8. Калинский М.И., Курский М.Д., Осипенко А.А. "Биохимические механизмы адаптации при мышечной деятельности" Киев. Изд. "Выща школа" 1986 г. 183 стр. 9. Мак-Комас А.Дж. "Скелетные мышцы" Изд. "Олимпийская литература" Киев 2001 г. 407 стр. 10. Меерсон Ф.З "Адаптационная медицина: концепция долговременной адаптации" Москва. Изд. "Дело" 1993 г. 138 стр. 11. Меерсон Ф.З. Пшенникова М.Г. "Адаптация к стрессовым ситуациям и физическим нагрузкам" Москва. Изд. "Медицина" 1988 г. 253 стр. 12. Селуянов В.Н. "Разработка методов и планов физической подготовки спортсменов на основе имитационного моделирования" Из сборника "Теория и практика применения дидактики развивающего обучения в подготовке специалистов по физическому воспитанию" Изд. "Физкультура, образование и наука". Труды сотрудников проблемной научно-исследовательской лаборатории / Научный руководитель В.Н.Селуянов. — М: Физкультура, образование и наука, 1996. — 106 стр. 13. Сингер М., Берг П. "Гены и геномы" в 2-х томах Изд. "Мир" Москва 1998г. 764 стр. 14. Улумбеков Э.Г., Челышев Ю.А. "Гистология, введение в патологию", Москва "ГЕОТАР Медицина" 1998 г. 15. Шекман Б.С. "Влияние тренировки на композицию мышц, размер и окислительный потенциал мышечных волокон у человека" Диссертационная работа. Москва 1990 г. 16. Шубникова Е.А., Юрина Н.А., Гусев Н.Б., Балезина О.П., Большакова Г.Б. "Мышечные ткани" Москва "Медицина" 2001 г. 17. Яковлев Н.Н. "Биохимия спорта" Изд. "Физкультура и спорт". Москва 1974 г. 288 стр. 18. Яковлев Н.Н., Коробков А.В., Янанис С.В. "Физиологические и биохимические основы теории и методики спортивной тренировки" Изд. "Физкультура и спорт". Москва 1957 г. 323 стр. 19. Allen DL, Linderman JK, Roy RR, Bigbee AJ, Grindeland RE, Mukku V, Edgerton VR (1997) "Apoptosis: a mechanism contributing to remodeling of skeletal muscle in response to hindlimb unweighting" Am J Physiol. 1997 Aug; 273(2 Pt 1):C579-87. 20. Allen DL, Monke SR, Talmadge RJ, Roy RR, Edgerton VR (1995) "Plasticity of myonuclear number in hypertrophied and atrophied mammalian skeletal muscle fibers" J Appl Physiol 78: 1969-1976, 1995; 21. Allen DL, Yasui W, Tanaka T, Ohira Y, Nagaoka S, Sekiguchi C, Hinds WE, Roy RR, Edgerton VR (1996) "Myonuclear number and myosin heavy chain expression in rat soleus single muscle fibers after spaceflight" J Appl Physiol. 1996 Jul;81(1):145-51. 22. Allen RE, Rankin LL (1990) "Regulation of satellite cells during skeletal muscle growth and development" Proc Soc Exp Biol Med. 1990 Jun;194(2):81-6. 23. Alway SE, Grumbt WH, Gonyea WJ, Stray-Gundersen J (1989a) "Contrasts in muscle and myofibers of elite male and female bodybuilders" J Appl Physiol. 1989 Jul;67(1):24-31 24. Alway SE, Winchester PK, Davis ME, Gonyea WJ (1989b) "Regionalized adaptations and muscle fiber proliferation in stretch-induced enlargement" J Appl Physiol. 1989 Feb;66(2):771-81. 25. Antonio J, Gonyea WJ (1993 a) "Role of muscle fiber hypertrophy and hyperplasia in intermittently stretched avian muscle" J Appl Physiol. 1993 Apr;74(4):1893-8 26. Antonio J, Gonyea WJ (1993 b) "Progressive stretch overload of skeletal muscle results in hypertrophy before hyperplasia" J Appl Physiol. 1993 Sep;75(3):1263-71. 27. Appell HJ, Forsberg S, Hollmann W (1988) "Satellite cell activation in human skeletal muscle after training: evidence for muscle fiber neoformation" Int J Sports Med. 1988 Aug;9(4):297-9. 28. Bruusgaard JC, Liestol K, Ekmark M, Kollstad K, Gundersen K (2003) "Number and spatial distribution of nuclei in the muscle fibres of normal mice studied in vivo" J Physiol. 2003 Sep 1;551(Pt 2):467-78. Epub 2003 Jun 17. 29. Burleigh IG (1977) "Observations on the number of nuclei within the fibres of some red and white muscles" J Cell Sci. 1977 Feb;23:269-84. 30. Cabric M, Appell HJ, Resic A (1987) "Effects of electrical stimulation of different frequencies on the myonuclei and fiber size in human muscle" Int J Sports Med. 1987 Oct;8(5):323-6. 31. Cabric M, James NT (1983) "Morphometric analyses on the muscles of exercise trained and untrained dogs" Am J Anat.166(3):359-68. 32. Cheek DB (1985) "The control of cell mass and replication. The DNA unit — a personal 20-year study" Early Hum Dev. 1985 Dec;12(3):211-39. 33. Darr KC, Schultz E (1987) "Exercise-induced satellite cell activation in growing and mature skeletal muscle" J Appl Physiol. 1987 Nov;63(5):1816-21 34. Dmitrieva EV (1975) "The role of the buds and myoblasts in reparative regeneration of muscle fibers of the skeletal type" Arkh Anat Gistol Embriol. 1975 Feb;68(2):37-43. 35. Enesco M, Puddy D "Increase in the number of nuclei and weight in skeletal muscle of rats of various ages" (1964) Amer . J. Anat.114:235 36. Fry DM, Morales MF (1980) "A reexamination of the effects of creatine on muscle protein synthesis in tissue culture" J Cell Biol. 1980 Feb;84(2):294-7. 37. Giddings CJ, Gonyea WJ (1992) "Morphological observations supporting muscle fiber hyperplasia following weight-lifting exercise in cats" Anat Rec.1992 Jun;233(2):178-95 38. Gollnick PD, Timson BF, Moore RL, Riedy M (1981) "Muscular enlargement and number of fibers in skeletal muscles of rats" J Appl Physiol. 1981 May;50(5):936-43. 39. Gollnick PD, Parsons D, Riedy M, Moore RL (1983) "Fiber number and size in overloaded chicken anterior latissimus dorsi muscle" J Appl Physiol. 1983 May;54(5):1292-7. 40. Gonyea W, Ericson GC, Bonde-Petersen F "Skeletal muscle fiber splitting induced by weight-lifting exercise in cats" Acta Physiol Scand. 1977 Jan;99(1):105-9. 41. Gonyea WJ, Sale DG, Gonyea FB, Mikesky A (1986) "Exercise induced increases in muscle fiber number" Eur J Appl Physiol Occup Physiol. 1986;55(2):137-41. 42. Gustafsson JA, Saartok T, Dahlberg E, Snochowski M, Haggmark T, Eriksson E (1984) "Studies on steroid receptors in human and rabbit skeletal muscle — clues to the understanding of the mechanism of action of anabolic steroid" Prog Clin Biol Res. 1984;142:261-90 43. Ingjer F (1979) "Effects of endurance training on muscle fibre ATP-ase activity, capillary supply and mitochondrial content in man" J Physiol. 1979 Sep;294:419-32. 44. Ingwall JS, Morales MF, Stockdale FE (1972) "Creatine and the control of myosin synthesis in differentiating skeletal muscle" Proc Natl Acad Sci USA. 1972 Aug;69(8):2250-3. 45. Ingwall JS, Weiner CD, Morales MF, Davis E, Stockdale FE (1974) "Specificity of creatine in the control of muscle protein synthesis" J Cell Biol. 1974 Jul;62(1):145-51 46. James NT, Cabric M (1981) "Quantitative studies on the numerical frequency of myonuclei in the muscles of exercised rats: evidence against the occurrence of fibre-splitting" Br J Exp Pathol. 1981 Dec;62(6):600-5. 47. Kadi F, Eriksson A, Holmner S, Butler-Browne GS, Thornell LE (1999а) "Cellular adaptation of the trapezius muscle in strength-trained athletes" Histochem Cell Biol. 1999 Mar;111(3):189-95. 48. Kadi F, Eriksson A, Holmner S, Thornell LE (1999b) "Effects of anabolic steroids on the muscle cells of strength-trained athletes" Med Sci Sports Exerc. 1999 Nov;31(11):1528-34. 49. Kasper CE, Xun L (1996) "Cytoplasm-to-myonucleus ratios in plantaris and soleus muscle fibres following hindlimb suspension" J Muscle Res Cell Motil. 1996 Oct;17(5):603-10 50. Kelly FJ, Lewis SE, Anderson P, Goldspink DF (1984) "Pre- and postnatal growth and protein turnover in four muscles of the rat" Muscle Nerve. 1984 Mar-Apr;7(3):235-42. 51. Kennedy JM, Eisenberg BR, Reid SK, Sweeney LJ, Zak R (1988) "Nascent muscle fiber appearance in overloaded chicken slow-tonic muscle" Am J Anat. 1988 Feb;181(2):203-15. 52. Kondalenko VF, Sergeev IP, Ivanitskaia VV (1981) "Electron microscopic study of signs of skeletal muscle fiber hyperplasia in athletes" Arkh Anat Gistol Embriol. 1981 Jun;80(6):66-70. 53. Larsson L., Tesch PA (1986) "Motor unit fiber density in extremely hypertriphied skeletal muscles in man" Eur J Appl Physiol Occup Physiol. 1986;55(2):130-6. 54. MacDougall JD, Sale DG, Elder GC, Sutton JR (1982) "Muscle ultrastructural characteristics of elite powerlifters and bodybuilders" Eur J Appl Physiol Occup Physiol. 1982;48(1):117-26. 55. MacDougall JD, Sale DG, Alway SE, Sutton JR (1984) "Muscle fiber number in biceps brachii in bodybuilders and control subjects" J Appl Physiol. 1984 Nov;57(5):1399-403. 56. Manta P, Vassilopoulos D, Spengos M (1987) "Nucleo-cytoplasmic ratio in ageing skeletal muscle" Eur Arch Psychiatry Neurol Sci. 1987;236(4):235-6. 57. Mauro A (1961) "Satellite cell of skeletal muscle fibers" J Biophys Biochem Cytol 9: 493-498, 1961 58. McCall, GE, Allen DL, Linderman JK, Grindeland RE, Roy RR, Mukku VR, and Edgerton VR (1998) "Maintenance of myonuclear domain size in rat soleus after overload and growth hormone/IGF-I treatment" J Appl Physiol 84: 1407-1412, 1998 59. McCall GE, Byrnes WC, Dickinson A, Pattany PM, Fleck SJ (1996) "Muscle fiber hypertrophy, hyperplasia, and capillary density in college men after resistance training" J Appl Physiol. 1996 Nov;81(5):2004-12. 60. McCormick KM, Thomas DP (1992) "Exercise-induced satellite cell activation in senescent soleus muscle" J Appl Physiol. 1992 Mar;72(3):888-93. 61. Moss FP (1968) "The relationship between the dimensions of the fibers and the number of nuclei during normal growth of skeletal muscle in the domestic fowl" Amer. J. Anat. 122:555. 62. Moss FP, Leblond CP (1970) "Nature of dividing nuclei in skeletal muscle of growing rats" J Cell Biol. 44(2):459-62. 63. Mozdziak PE, Schultz E, Cassens RG (1997) "Myonuclear accretion is a major determinant of avian skeletal muscle growth" Am J Physiol. 1997 Feb;272(2Pt1):C565-71. 64. Mozdziak PE, Pulvermacher PM, Schultz E (2000) "Unloading of juvenile muscle results in a reduced muscle size 9 wk after reloading" J Appl Physiol 88:158-164, 2000 65. Musacchia XJ, Deavers DR, Meininger GA, Davis TP (1980) "A model for hypokinesia: effects on muscle atrophy in the rat" J Appl Physiol. 1980 Mar;48(3):479-86. 66. Ogilvie RW, Armstrong RB, Baird KE, Bottoms CL (1988) "Lesions in the rat soleus muscle following eccentrically biased exercise" Am J Anat. 1988 Aug; 182(4):335-46. 67. Ohira Y, Yoshinaga T, Ohara M, Nonaka I, Yoshioka T, Yamashita-Goto K, Shenkman BS, Kozlovskaya IB, Roy RR, Edgerton VR (1999) "Myonuclear domain and myosin phenotype in human soleus after bed rest with or without loading" J Appl Physiol. 1999 Nov;87(5):1776-85 68. Pacy PJ, Evans RH, Halliday D (1987) "Effect of anaerobic and aerobic exercise promoted by computer regulated functional electrical stimulation (FES) on muscle size, strength and histology in paraplegic males" Prosthet Orthot Int. 1987 Aug;11(2):75-9. 69. Pavlath GK, Rich K, Webster SG, Blau HM (1989) "Localization of muscle gene products in nuclear domains" Nature. 1989 Feb 9;337(6207):570-3. 70. Pullman WE, Yeoh GC (1977) "The role of myonuclei in muscle regeneration: an in vitro study" J Cell Physiol. 1978 Aug;96(2):245-51. 71. Ralston E, Hall ZW (1992) "Restricted distribution of mRNA produced from a single nucleus in hybrid myotubes" The Journal of Cell Biology, Vol 119, 1063-1068 72. Rayne J, Crawford GN (1975) "Increase in fibre numbers of the rat pterygoid muscles during postnatal growth" J Anat. 1975 Apr;119(2):347-57. 73. Rosenblatt JD, Yong D, Parry DJ (1994) "Satellite cell activity is required for hypertrophy of overloaded adult rat muscle" Muscle Nerve. 1994 Jun;17(6):608-13. 74. Roth SM, Martel GF, Ivey FM, Lemmer JT, Tracy BL, Metter EJ, Hurley BF, Rogers MA (2001) "Skeletal muscle satellite cell characteristics in young and older men and women after heavy resistance strength training" J Gerontol A Biol Sci Med Sci. 2001 Jun;56(6):B240-7. 75. Roy RR, Monke SR, Allen DL, Edgerton VR (1999) "Modulation of myonuclear number in functionally overloaded and exercised rat plantaris fibers" J Appl Physiol. 1999 Aug;87(2):634-42. 76. Salleo A, Anastasi G, La Spada G, Falzea G, Denaro MG (1980) "New muscle fiber production during compensatory hypertrophy" Med Sci Sports Exerc. 1980;12(4):268-73. 77. Seiden D (1976) "Quantitative analysis of muscle cell changes in compensatory hypertrophy and work-induced hypertrophy" Am J Anat. 1976 Apr;145(4):459-65. 78. Sinha-Hikim I, Roth SM, Lee MI, Bhasin S (2003) "Testosterone-induced muscle hypertrophy is associated with an increase in satellite cell number in healthy, young men" Am J Physiol Endocrinol Metab 285: E197-E205, 2003. First published April 1, 2003 79. Sjostrom M, Lexell J, Eriksson A, Taylor CC (1991) "Evidence of fibre hyperplasia in human skeletal muscles from healthy young men? A left-right comparison of the fibre number in whole anterior tibialis muscles" Eur J Appl Physiol Occup Physiol. 1991;62(5):301-4. 80. Smith HK, Maxwell L, Martyn JA, Bass JJ (2000) "Nuclear DNA fragmentation and morphological alterations in adult rabbit skeletal muscle after short-term immobilization" Cell Tissue Res. 2000 Nov;302(2):235-41. 81. Snow MH (1977) "Myogenic cell formation in regenerating rat skeletal muscle injured by mincing. II. An autoradiographic study" Anat Rec. 1977 Jun;188(2):201-17 82. Snow MH (1990) "Satellite cell response in rat soleus muscle undergoing hypertrophy due to surgical ablation of synergists" Anat Rec. 1990 Aug;227(4):437-46. 83. Snow MH, Chortkoff BS (1987) "Frequency of bifurcated muscle fibers in hypertrophic rat soleus muscle" Muscle Nerve. 1987 May;10(4):312-7. 84. Staron RS, Malicky ES, Leonardi MJ, Falkel JE, Hagerman FC, Dudley GA (1990) "Muscle hypertrophy and fast fiber type conversions in heavy resistance-trained women" Eur J Appl Physiol Occup Physiol. 1990; 60 (1):71-9 85. Tamaki T, Akatsuka A, Tokunaga M, Ishige K, Uchiyama S, Shiraishi T (1997) "Morphological and biochemical evidence of muscle hyperplasia following weight-lifting exercise in rats" Am J Physiol. 1997 Jul;273(1 Pt 1):C246-56. 86. Tamaki T, Akatsuka A, Yoshimura S, Roy RR, Edgerton VR (2002) "New fiber formation in the interstitial spaces of rat skeletal muscle during postnatal growth" J Histochem Cytochem. 2002 Aug;50(8):1097-111 87. Tamaki T, Uchiyama S, Nakano S (1992) "A weight-lifting exercise model for inducing hypertrophy in the hindlimb muscles of rats" Med Sci Sports Exerc. 1992 Aug;24(8):881-6. 88. Timson BF, Bowlin BK, Dudenhoeffer GA, George JB (1985) "Fiber number, area, and composition of mouse soleus muscle following enlargement" J Appl Physiol. 1985 Feb;58(2):619-24. 89. Tseng BS, Kasper CE, Edgerton VR (1994) "Cytoplasm-to-myonucleus ratios and succinate dehydrogenase activities in adult rat slow and fast muscle fibers" Cell Tissue Res. 1994 Jan;275(1):39-49 90. Vassilopoulos D, Lumb EM, Emery AE (1977) "Karyometric changes in human muscle with age" Eur Neurol. 1977;16(1-6):31-4. 91. Wang N, Hikida RS, Staron RS, Simoneau JA (1993) "Muscle fiber types of women after resistance training — quantitative ultrastructure and enzyme activity" Pflugers Arch. 1993 Sep;424(5-6):494-502. 92. Winchester PK, Davis ME, Alway SE, Gonyea WJ (1991) "Satellite cell activation in the stretch-enlarged anterior latissimus dorsi muscle of the adult quail" Am J Physiol Cell Physiol 260: C206-C212, 1991 93. Winchester PK, Gonyea WJ (1992) "Regional injury and the terminal differentiation of satellite cells in stretched avian slow tonic muscle" Dev Biol. 1992 Jun;151(2):459-72 94. Young RB, Denome RM (1984) "Effect of creatine on contents of myosin heavy chain and myosin-heavy-chain mRNA in steady-state chicken muscle-cell cultures" Biochem J. 1984 Mar 15;218(3):871-6. 95. Zilber ML, Litvinova VN, Morozov VI, Pliskin AV, Pshendin AI, Rogozkin VA (1976) "The creatine effect on RNA and protein synthesis in growing culture of chick embryo myoblasts" Biokhimiia. 1975 Jul-Aug;40(4):854-60
Автор: В.А.Протасенко
Комментариев нет:
Отправить комментарий